Hroniska nieru slimība (HNS) kļūst par vienu no pasaulē visizplatītākajām hroniskajām ne–infekcijas slimībām. PVO prognozē, ka līdz 2040. gadam HNS kļūs par piekto visbiežāko hronisko slimību.
[1] HNS un ar to saistītās kardiovaskulārās komplikācijas ievērojami samazina kvalitatīvi nodzīvotus gadus, tāpēc ir svarīgi izvēlēties terapiju, kas aizkavē HNS progresēšanu, terminālas nieru mazspējas attīstību, kā arī uzlabo kardiovaskulāro slimību gaitu pacientiem ar HNS.
[1; 2]. * minerālkortikoīdu receptoru antagonisti
Vairākus gadu desmitus nefroloģijā ir pazīstami steroīdie minerālkortikoīdu receptoru antagonisti, piemēram, spironolaktons un eplerenons, kas iedarbojas diurētiski un antihipertensīvi. Tomēr to izmantošana ir limitēta tādu blakusparādību dēļ kā hiperkaliēmija, ginekomastija, impotence un amenoreja. Savukārt pētījumi pēdējos gados vērsti uz nesteroīdo minerālkortikoīdu receptoru antagonistu (nsMRA) izstrādi ar augstu selektivitāti un afinitāti pie minerālkortikoīdu receptoriem, lai mazinātu nevēlamās blakusparādības. 2021. gadā ASV Pārtikas un zāļu pārvalde (Food and Drug Administration []) un 2022. ga-dā Eiropas Zāļu aģentūra (European Medicines Agency []) apstiprināja finerenonu kā pirmo klīniskajā praksē lietojamo nsMRA.
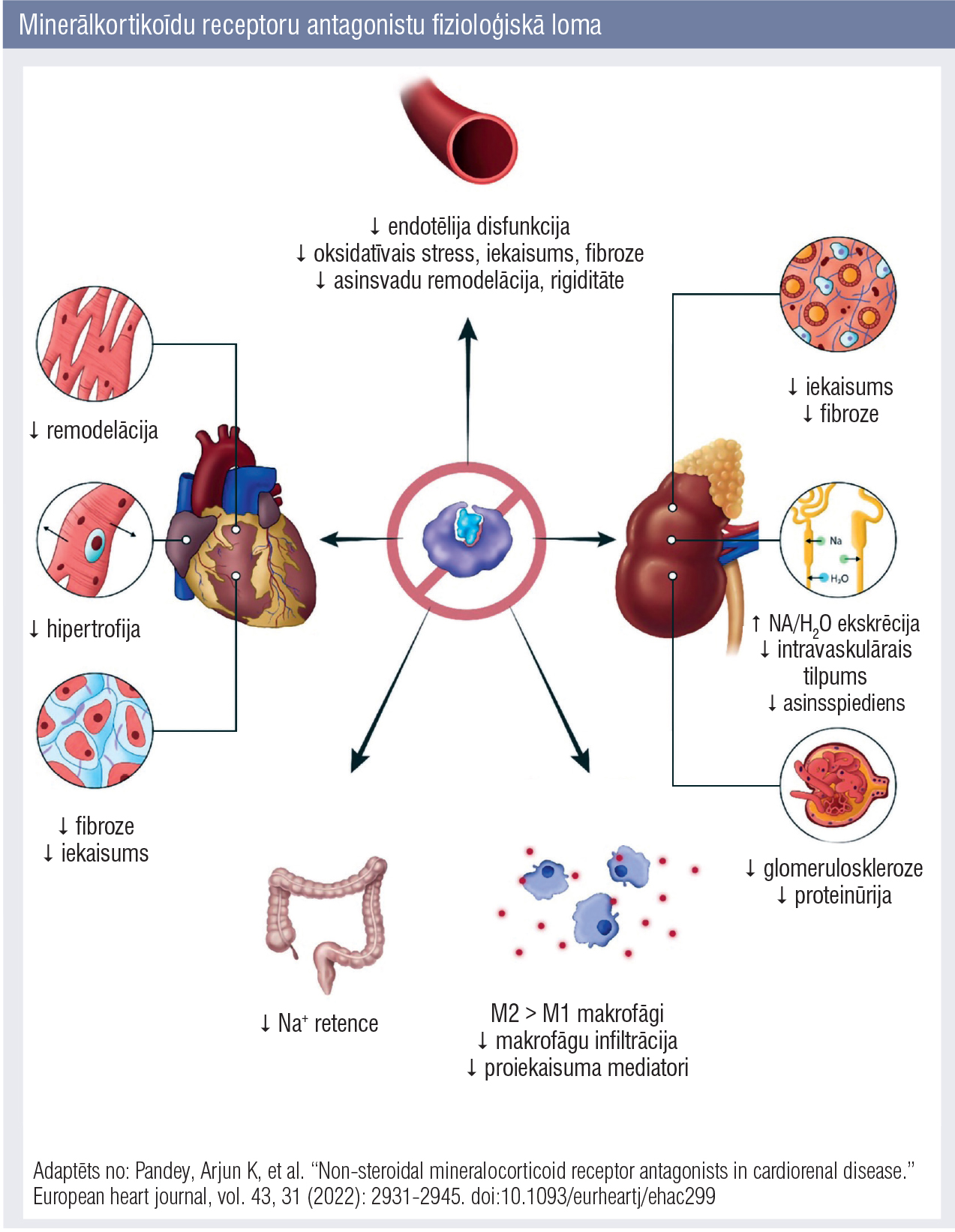

1.attēls
Minerālkortikoīdu receptoru antagonistu fizioloģiskā loma
Fizioloģiskie minerālkortikoīdu receptoru (MR) ligandi pamatā ir aldosterons un 11–dezoksikortikosterons. Šie receptori atrodami dažādos audos un šūnās: kardiomiocītos, asinsvadu endotēlija šūnās, asinsvadu gludajā muskulatūrā, nieru tubulārajās epitēlija šūnās un makrofāgos, monocītos un T limfocītos. Distālajās nieru tubulārajās epitēlija šūnās aldosterons saistās ar MR, veidojot aldosterona—MR kompleksu, kas veicina nātrija reabsorbciju un kālija un ūdeņraža jonu izdalīšanos, tādējādi minerālkortikoīdu receptori veic svarīgu fizioloģisku lomu ūdens un sāls līdzsvara, asinsspiediena un cirkulējošā asins tilpuma regulēšanā. [4] Minerālkortikoīdu receptoru antagonistu fizioloģiskā loma apkopota 1. attēlā
nsMRA loma klīniskajā praksē
Finerenons, kas klasificēts kā trešās paaudzes izteikti selektīvs nsMRA, nodrošina tiešu un specifisku minerālkortikoīdu receptoru bloķēšanu, samazinot sirds, nieru un asinsvadu iekaisumu, remodelāciju un fibrozi. Finerenona efektivitāte minerālkortikoīdu receptoru bloķēšanā ir līdzīga spironolaktonam, taču tā zemā lipofilitāte un augstā polaritāte rezultējas samazinātā iespējā šķērsot hematoencefālisko barjeru un vienmērīgā izkliedē sirds un nieru audos. Perorāli lietojot finerenonu, tas pilnībā tiek absorbēts gastrointestinālajā traktā. Tā eliminācijas pusperiods ir īsāks nekā spironolaktonam un eplerenonam, kas izskaidro tā minimālo ietekmi uz kālija līmeni serumā. [3; 5]
Pirms finerenona lietošanas sākšanas jānosaka kālija līmenis asinīs, jo netiek rekomendēta tā lietošana, ja kālija līmenis serumā virs 5 mmol/l. Ja kālija līmenis serumā ir 4,8—5 mmol/l, terapiju var apsvērt, pirmās četras nedēļas regulāri kontrolējot kālija līmeni. Šī terapija netiek rekomendēta pacientiem ar aprēķināto glomerulu filtrācijas ātrumu (aGFĀ) zem 25 ml/min./1,73 m2.
Finerenonu nav ieteicams lietot kopā ar dažām antibiotikām (klaritromicīnu, telitromicīnu), pretsēnīšu preparātiem (itrakonazolu, ketokonazolu) vai pretvīrusu medikamentiem cilvēka imūndeficīta vīrusa vai C hepatīta ārstēšanai. [11]
Finerenons un eplerenons
European Heart Journal 2016. gadā publicētajā pētījumā tika salīdzināta finerenona un eplerenona lietošanas iedarbība pacientiem ar progresējošu hronisku sirds mazspēju un 2. tipa cukura diabētu un/vai hronisku nieru mazspēju. Netika pierādīta statistiski nozīmīga atšķirība NT–proBNP līmeņa pazeminājumā, asinsspiediena pazeminājumā, aGFĀ pieaugumā abās grupās.
Taču tika pierādīta sakarība, ka pacientiem, kuri saņēma finerenonu, gandrīz visās devu grupās bija zemāks risks mirstībai, hospitalizācijai kardiovaskulāru notikumu dēļ un hospitalizācijai sirds mazspējas dekompensācijas dēļ. Izteiktāka labvēlīgā ietekme bija pacientiem, kuri finerenonu lietoja devā 10—20 mg. Papildu priekšrocība finerenonam bija labāka panesība, jo retāk radās hiperkaliēmija, salīdzinot ar eplerenonu, kas ir īpaši svarīgi pacientiem ar hronisku nieru mazspēju. [7]
Finerenons HNS pacientiem ar 2. tipa CD
Finerenona neaizvietojamo pozīciju mūsdienīgā sirds un nieru protekcijā noteica divi nozīmīgi pētījumi, ar kuriem pamatotas rekomendācijas finerenona lietošanai arī aktuālajās HNS ārstēšanas vadlīnijās pacientiem ar 2. tipa cukura diabētu.
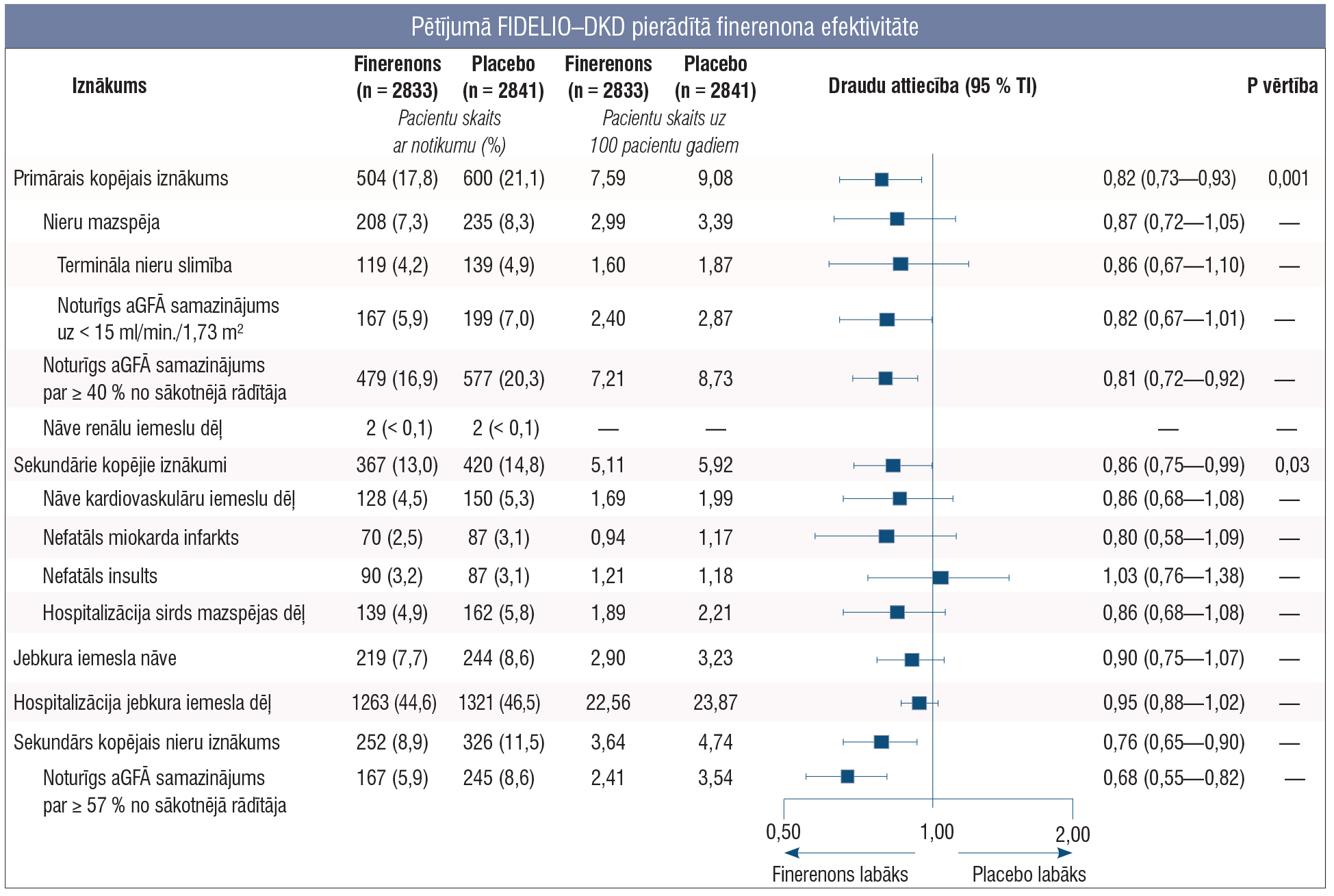

2.attēls
Pētījumā FIDELIO–DKD pierādītā finerenona efektivitāte
2020. gadā New England Journal of Medicine publicēja pētījumu FIDELIO–DKD par finerenona efektivitāti hroniskas nieru slimības terapijā pacientiem ar 2. tipa cukura diabētu un albuminūriju (2. attēls). Pētījumā 10 mg vai 20 mg finerenona devas efekti tika salīdzināti ar placebo, vienlaikus nodrošinot, ka visi pacienti saņēma angiotensīnu konvertējošā enzīma inhibitoru (AKEi) vai angiotensīna receptoru blokatoru (ARB) maksimālajā antihipertensīvajā devā vai maksimālajā panesamajā devā. Pētījuma rezultāti atklāja, ka finerenons ievērojami samazina primārā iznākuma riska rādītājus: nieru mazspējas iestāšanos vai noturīgu GFĀ samazinājumu ≥ 40 % no izejas aGFĀ, vai nāvi nieru slimības dēļ. Lietojot finerenonu, šo notikumu sastopamība bija par 18 % zemāka nekā placebo grupā. Īpaši ievērojams uzlabojums bija pacientiem ar progresējošu 3.—4. pakāpes HNS.
Bez primāro iznākumu samazinājuma finerenona grupā bija arī mazāks risks sekundāro iznākumu rādītājos, kas ietver nāvi kardiovaskulāra notikuma dēļ, miokarda infarktu, insultu vai hospitalizāciju sirds mazspējas dēļ. Salīdzinot ar placebo grupu, šis risks bija par 14 % zemāks. Tātad finerenons ne tikai uzlabo nieru veselību, bet arī būtiski samazina kardiovaskulāro komplikāciju biežumu. [6; 8]
Pēc gada New England Journal of Medicine publicēja pētījumu FIGARO–DKD par kardiovaskulāro notikumu biežumu 2. tipa cukura diabēta pacientiem ar HNS un albuminūriju, kuri lieto finerenonu. Finerenona grupā tika konstatēts par 13 % zemāks akūto kardiovaskulāro notikumu risks nekā placebo grupai. Taču šeit novēroja tendenci, bet ne statistiski nozīmīgu uzlabojumu sekundāro nieru iznākumu rādītājos finerenona grupai. [8; 9]
Jāpiebilst, ka 2019. gadā Japānā tika apstiprināts arī nsMRA medikaments esakserenons, kuru pamatā izmanto primāras hipertensijas ārstēšanai. Pētījumos pierādīta tā antihipertensīvā ietekme un iespēja ierobežot sirds remodelāciju un fibrozi. [5] Japānā veiktā pētījumā esakserenons samazināja albuminūriju pacientiem ar diabētisku nefropātiju, taču 4 % esakserenona grupas pacientu šo pētījumu nepabeidza hiperkaliēmijas dēļ (iepretī 0,4 % pacientu placebo grupā). [5; 10]
Noslēgumā
Varam secināt, ka nsMRA, īpaši finerenons, ir indicēts pacientiem ar 2. tipa cukura diabētu un HNS, kuriem ir palielināts risks nelabvēlīgiem nieru un kardiovaskulāriem notikumiem, lai gan viņi lieto standarta terapijas līdzekļus. Finerenons efektivitāti pierādījis, aizkavējot nieru un sirds mazspējas progresēšanu, kā arī samazinot mirstību un hospitalizāciju šo slimību dēļ.
nsMRA var izraisīt hiperkaliēmiju, taču retāk nekā spironolaktons un eplerenons. Tāpēc svarīgi atcerēties, ka paaugstinātā hiperkaliēmijas riska dēļ nedrīkst kombinēt nesteroīdos MRA un steroīdos MRA. Finerenons ikdienas klīniskajā praksē ir jauns pagrieziena punkts hroniskas nieru slimības un ar to saistīto kardiovaskulāro komplikāciju ārstēšanā. [7; 8] Tomēr ilgtermiņa efektivitātes un drošuma novērtēšanai nepieciešami novērojumu pētījumi reālajā klīniskajā praksē, kā arī turpmāki pētījumi par nsMRA kombinēšanu ar citiem nefroprotektīviem un kardioprotektīviem medikamentiem, piemēram, nātrija—glikozes līdztransportvielas–2 (SGLT2) inhibitoriem vai glikagonam līdzīgā peptīda–1 receptoru agonistiem (GLP1 RA).
KOPSAVILKUMS
- Steroīdo minerālkortikoīdu receptoru antagonistu izmantošana ir limitēta tādu blakusparādību dēļ kā hiperkaliēmija, ginekomastija, impotence un amenoreja.
- Pētījumi pēdējos gados vērsti uz nesteroīdo minerālkortikoīdu receptoru antagonistu (nsMRA) iz-strādi, lai mazinātu nevēlamās blakusparādības.
- nsMRA ir indicēti pacientiem ar 2. tipa cukura diabētu un HNS, kuriem ir palielināts risks nelabvēlīgiem nieru un kardiovaskulāriem notikumiem, lai gan viņi lieto standarta terapijas līdzekļus.
- Paaugstinātā hiperkaliēmijas riska dēļ nedrīkst kombinēt nsMRA un steroīdos MRA