Pēdējos 20 gados biozāļu izmantošana gājusi plašumā, tie veido vairāk nekā 40% no visiem medikamentiem ar būtiski strauju pieauguma tendenci tieši pēdējos gados. Biozāļu un biolīdzinieku tēma žurnālā Doctus jau iepriekš skatīta vairākos rakstos. Šoreiz skatījums cits — par atšķirībām starp dažādām biozālēm un iespēju tās “uztjūnēt” jeb uzlabot.
Aktualitāte
Pašreiz globālajā farmācijas tirgū ir vairāk nekā 650 biozāļu un biolīdzinieku, bet no tiem pegilētas biozāles ir mazāk par 20 (skat. tabulu). Tomēr to apgrozījums naudas izteiksmē 2012. gadā pasaulē mērāms 7 miljardos ASV dolāru! [1]
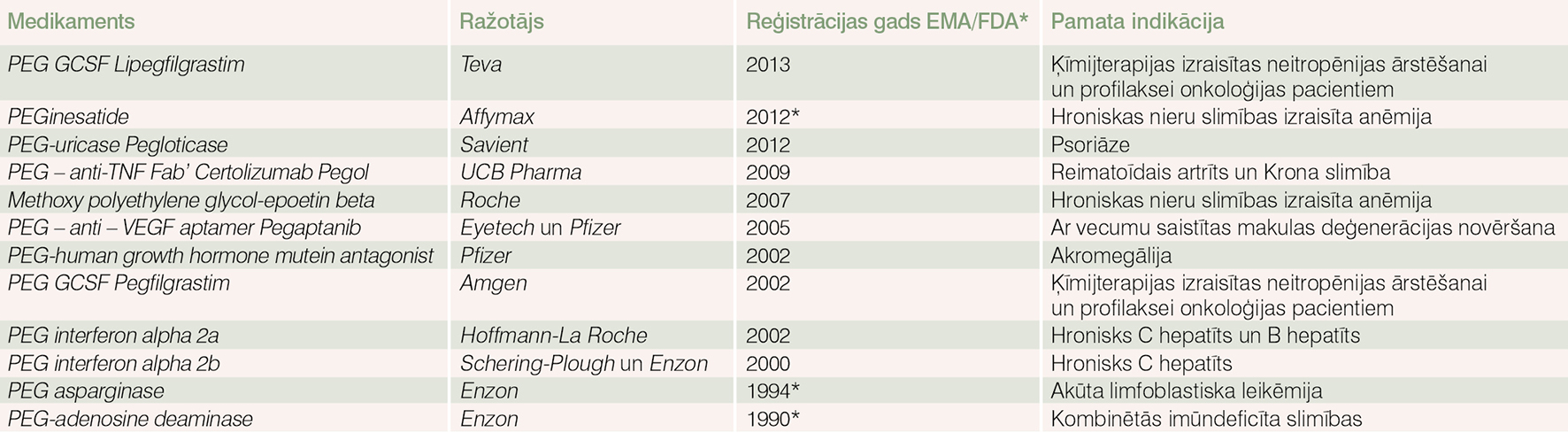

Tabula
PEGilētie medikamenti biozāļu tirgū
Ir zināms, ka daļa biozāļu sastāv no makromolekulāriem proteīniem jeb olbaltumvielām. Normālā situācijā tie veidojas vesela cilvēka organismā, bet reizēs, kad organismā ir to trūkums, tie rada stāvokļus, ko mēs saucam par slimībām. Faktiski biozāļu izmantošanas pamatā ir vienkārša ideja: kompensēt organismā dabiski veidojošos enzīmus un hormonus situācijās, kad to ir par maz vai kad tie neveidojas vispār. Ir situācijas, kad trūkstošos proteīnus dabiskā veidā iegūt nav iespējams vai arī tie ir ierobežotā daudzumā. Tad zinātnieki izmanto gēnu inženierijas metodes, t.i., iegūst rekombinētu proteīnu DNS, tādējādi kopējot un nedaudz uzlabojot dabiskos proteīnus cilvēka organismā. Biozāles, kuru sastāvā ir izmainīti (uzlaboti) proteīni, uz organisma dinamiskajiem procesiem iedarbojos selektīvāk un labāk kontrolē slimības gaitu, salīdzinot ar dabiskajiem proteīniem. Pirmie bioloģiskie proteīni, ko izmantoja dažādu slimību ārstēšanai, tika iegūti no dzīvniekiem vai no mikroorganismu šūnām, un tie bija līdzīgi, bet ne identiski cilvēka bioloģiskajiem proteīniem. Tā kā proteīni strukturāli atšķīrās, cilvēka organisms tos uztvēra par svešiem un attiecīgi reaģēja uz tiem kā uz svešiem, tādējādi radot imunoloģisku atbildi.
Līdz ar biozāļu plašāku izmantošanu pieauga arī vēlme tās uzlabot, jo daudzām no tām bija nepilnības, kas raksturīgas polipeptīdu struktūrām, piemēram, īss cirkulācijas laiks asins plazmā, imunogenitāte (imūnās atbildes veidošanās pret organismam svešo proteīnu), proteolītiskā degradācija un vāja šķīdība. Lai risinātu šos sarežģījumus, tika veikti vairāki proteīnu struktūras uzlabojami, piemēram:
- manipulācijas ar aminoskābju sekvenci (atkārtošanos) proteīna molekulā jeb rindas kārtības izmaiņu, kā rezultātā tiek uzlabota imunogenitāte un ir iespējams izvairīties no proteolītiskās degradācijas;
- saplūšana vai savienošana ar imūnglobulīniem vai seruma albumīniem;
- iekļaušana zāļu transporta sistēmās (izmainīta zāļu forma), tādējādi tās aizsargājot un palēninot to izdalīšanos;
- savienošana ar dabiskiem vai sintētiskiem polimēriem.
Rekombinētās DNS tehnoloģija ļauj pārvarēt šķēršļus, kas saistīta ar šo organismam specifisko proteīnu rūpniecisko ražošanu. Tā ļauj saražot vajadzīgos proteīnus neierobežotā daudzumā, uzlabo to drošumu, kā arī ļauj iegūt proteīnus ar dažādām klīniskām priekšrocībām, salīdzinot ar dabiskajiem proteīniem cilvēka organismā.
Tomēr arī rekombinēto proteīnu darbībai ir daži ierobežojumi:
- salīdzinoši īss pusizvades periods, tāpēc zāļu devas jāievada bieži;
- sliktāka aktīvo vielu stabilitāte un paātrināta izvade caur nierēm.
Vēsture
PEGilēšanu pirmoreiz aprakstījuši Frank F. Davies un Abraham Abuchowsky 1970. gados. Autori konstatēja un ieviesa tehnoloģiju, kas deva iespēju modificēt albumīnu un katalāzi. Tolaik tā bija pilnīgi jauna pieeja, jo iepriekš nebija iespējams delikāti izmainīt organisma proteīnu un enzīmu aktivitāti, kardināli neizmainot proteīnu struktūru.
Kas ir PEG?
Etilēnglikols (etāndiols, HOCH2CH2OH- monomērs) ir bezkrāsas viskozs šķidrums ar saldu garšu. Etilēnglikols ir vienkāršākais divvērtīgais spirts. Etilēnglikolu iegūst no etilēna oksīda (C2H4O) reakcijā ar ūdeni: C2H4O + H2O → HOCH2CH2OH (skat. 1. attēlu).

1. attēls
Etilēnglikola ķīmiskā struktūra
Etilēnglikola ieguves procesā noteiktos apstākļos rodas tā blakus produkti - dažādi etilēnglikola oligomēri vai polimēri. To daudzums palielinās, ja etilēna oksīds sāk reaģēt ar jau izveidojušos etilēnglikolu monomēriem.
Kas ir PEGilēšana?
PEGilēšana ir process, kad kovalenta polietilēnglikolu (PEG) ķēde tiek pievienota bioloģiskam proteīnam ar mērķi izmainīt proteīna īpašības, tādējādi ietekmējot gan farmakokinētiskās, gan farmakodinamiskās proteīna īpašības.
Pievienojot PEG ķēdi proteīnam, var maskēt imūnās sistēmas reaktivitāti uz proteīnu vai pagarināt proteīna darbības laiku plazmā. Ar PEGilēšanu iespējams izmainīt hidrofobu aktīvo vielu šķīdību ūdenī. PEGilēšanas procesā palielinot aktīvās vielas molekulmasu, iespējams iegūt vairākas priekšrocības, salīdzinot ar to pašu bioloģiski aktīvo vielu, bet neizmainītā formā, piemēram:
- uzlabojas aktīvās vielas šķīdība;
- samazinās devu ievades skaits;
- pagarinās pusizvades periods, kas palīdz nodrošināt stabilāku aktīvās vielas cirkulāciju organismā;
- palielinās aktīvo vielu stabilitāte;
- pieaug aizsardzība pret proteolītisko degradāciju.
Metoksi PEG CH30-(CH2CH20)n-H (mPEG) ir bāze visiem līdz šim biežāk lietotajiem PEGilētājiem medikamentiem (gan lineārā, gan cikliskā formā):
- CH30-(CH2CH2O)n-H - metoksipolietilēnglikols (mPEG);
- OH-(CH2CH2O)n-H - polietilēnglikols (PED Diol).
Divas svarīgākās šā polimēra īpašības ir lieliskā manevrējamība, kompaktums. PEG savai struktūrai piesaista ap 6-7 ūdens molekulām katram monomēram, rezultātā uzlabojas tā cirkulācija organismā. PEG šķīst lielākajā daļā organisko šķīdinātāju, kā arī veido plānu slāni uz ūdens-gaisa saskares virsmas līdzīgi virsmaktīvajām vielām. Daudzas PEGilēto proteīnu īpašības atkarīgas gan no molekulārās masas, gan koncentrācijas. PEG un tā savienojumi pamatā tiek izvadīti caur nierēm, bet izvadīšanas ātrums būtiski palēninās, ja kopējā molekulmasa ir tuva vai pārsniedz 40 kDA. Ja savienojums ar PEG pārsniedz 40 kDa, tas netiek izvadīts no organisma, tāpēc turpina cirkulēt asins plazmā, līdz pilnībā piesaistās organisma receptoriem. [5] Tādējādi PEG daļas izmēru var modelēt gan pēc pamatproteīna molekulmasas, gan nepieciešamā pusizvades perioda ilguma. Svarīga īpašība - PEG polimērs faktiski neietekmē pamatproteīna īpašības.
Drošuma jautājums vienmēr ir aktuāls. Toksikoloģiskais profils mPEG ir ļoti drošs un blakusparādības iespējamas tikai gadījumos, ja parenterāli ievadītas ļoti lielas devas. Piemēram, pētījumos ar trušiem konstatēts, ka pēc ļoti koncentrēta mPEG šķīduma (mPEG 750 Da; LD50 10 g/kg) i/v ievades notiek vakuolu veidošanās nieru epitēlija šūnās, bet citu veidu toksicitāte netika novērota. [5]
Kā notiek PEGilēšana?
PEGilēšanas procesā sākotnējā izvēle, kur piesaistīt PEG molekulu, bija par labu amino grupām, jo tās proteīnu struktūrā pārstāvētas plaši, ir tieši savienojamas un labi pakļaujas modificēšanas iespējām ar ķīmiskiem reaģentiem. Joprojām šī metode ir viena no vienkāršākajām PEGilēšanas metodēm. [3] Lielākā problēma, izmantojot šo nespecifisko metodi, ir lielais dažādo izomēru skaits, kas veidojas PEGilēšanas procesā. Parasti atsevišķu izomēru atdalīšana, lai iegūtu gala produktu, ir gana sarežģīta, tāpēc pirmās paaudzes PEG konjugāti, piemēram, PEG asparginase un PEG adenosine deaminase, ir reģistrēti un praksē lietoti medikamenti, kuru aktīvā viela ir PEGilētu proteīnu izomēru komplekss.
Attīstoties tehnoloģijām, pieaug arī prasības bioloģisko medikamentu reģistrācijai: ikviens izomērs jādala atsevišķi un jāreģistrē kā atsevišķs medikaments, jo katra izomēra īpašības var/mēdz būt atšķirīgas. Piemēram, ir divi interferona alfa konjugāti ar PEG, bet klīniski tie atšķiras gan pēc efektivitātes, gan blakņu profila, ir arī atšķirības to molekulārajā struktūrā. [2]
Pētījumi un tehnoloģiju progress ļauj izmantot t.s. specifisko piesaistes vietu aminomodificēšanu, kas atvieglo gan attīrīšanas, gan aktīvās vielas vai sastāva raksturošanas procedūras. Vietas specifiska konjugēšana ļauj saglabāt arī lielāku dabiskā proteīna aktivitāti. Izmantojot PEG aldehīdu, N terminālajai lizīna alfa amino grupai iespējams pievienot PEG. Pēc šīs metodes veidots garas darbības granulocītu koloniju stimulējošais faktors (GCSF) - pegfilgrastim, ko izmanto ķīmijterapijas izraisītas neitropēnijas un febrilas neitropēnijas ārstēšanā un profilaksē. [3; 5]
Viena no progresīvākajām PEGilēšanas metodēm ir enzimātiskā pegilēšana, kas notiek ar enzīmu - transglutamināžu palīdzību, PEG pievienojot serīnam vai treonīna hidroksilgrupai. [2; 3; 5]
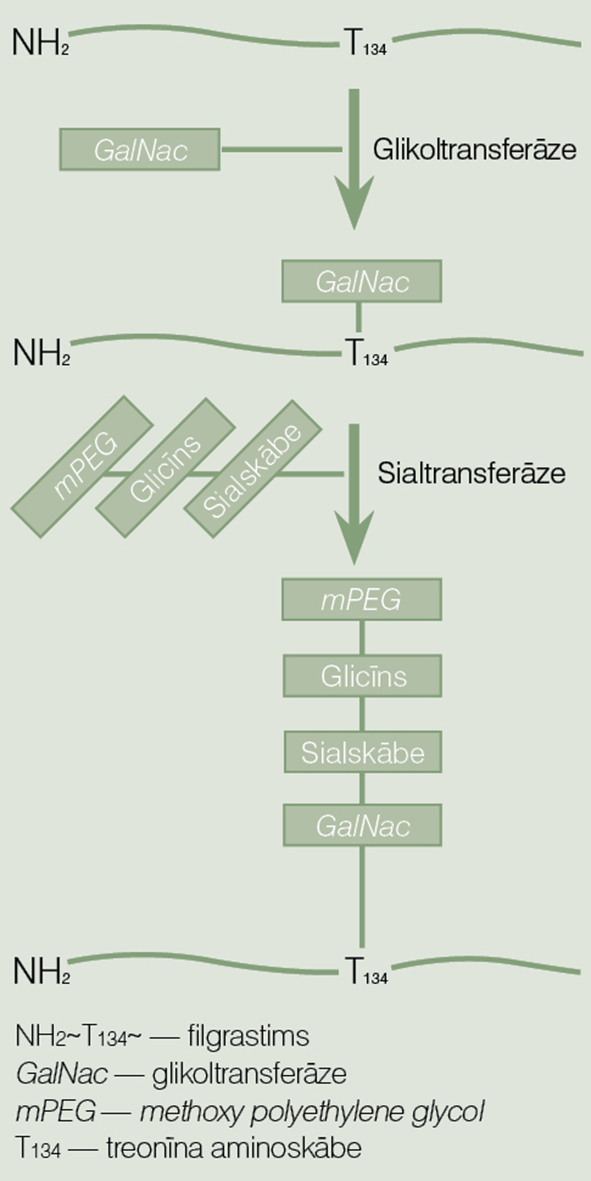

2. attēls
Lipegfilgrastima iegūšanas tehnoloģiskā shēma
Piemēram, īsas darbības GCSF jeb filgrastims tiek iegūts no E. coli šūnām, izmantojot rekombinēto DNS tehnoloģiju. Šo izaudzēto cilvēka proteīnam līdzīgo bioloģisko medikamentu pirms fermentēšanas sagatavo nākamajiem soļiem: homogenizācijai un attīrīšanai. Pēc starpprodukta sagatavošanas pie filgrastima molekulas ar transglutamināžu palīdzību pievieno 20 kDA lielu lineāru metoksi-PEG molekulu, tādējādi kopējo molekulmasu palielinot līdz 39kDA. MPEG molekulas pievienošana notiek sekvenciāli ar divu rekombinētu glikoltransferāžu palīdzību, par savienotāju izmantojot cukura nukleotīda donorsubstrātu (skat. 2. attēlu). [7; 8] Lipegfilgrastima sintēze notiek divpakāpju enzimātiskā reakcijā, metoksiPEG pievienojot treonīnam - 134. aminoskābei filgrastima aminoskābju ķēdē. Faktiski vienam un tam pašam pamata proteīnam, izmantojot dažādas PEGilēšanas metodes, iegūstam arī dažādas farmakokinētiskās un farmakodinamiskās īpašības. Izmantojot glikopegilēšanu jeb enzimātisko pegilēšanas metodi, filgrastima dabiskā struktūra netiek lauzta - netiek izmainīta aminoskābju ķēde. [6] Šo strukturālo atšķirību rezultātā lipegfilgrastims ir ieguvis izmainītu trīsdimensiju struktūru, kas, iespējams, veiksmīgāk saistās ar organisma receptoriem (skat. 3. attēlu). Šīs izmaiņas ne tikai strukturāli atšķiras, bet ietekmē arī filgrastima farmakodinamisko un farmakokinētisko profilu.
![Hipotētiskās strukturālās atšķirības starp lipegfilgrastim un pegfilgrastim [6]](https://cdn.doctus.lv/media/2014/03/2/original/8d9502799fc8.jpg)
![Hipotētiskās strukturālās atšķirības starp lipegfilgrastim un pegfilgrastim [6]](https://cdn.doctus.lv/media/2014/03/2/original/8d9502799fc8.jpg)
3. attēls
Hipotētiskās strukturālās atšķirības starp lipegfilgrastim un pegfilgrastim [6]
Pirmās fāzes klīniskajā pētījumā, salīdzinot 6 mg lipegfilgrastima un 6 mg pegfilgrastima vienreizēju ievadīšanu 36 veseliem brīvprātīgajiem, konstatēja, ka lipegfilgrastima pusizvades periods ir garāks, koncentrācijas maksimums plazmā par 36% augstāks, kā arī laukums zem līknes (AUC) par aptuveni 64% lielāks, salīdzinot ar pegfilgrastimu (skat. 4. attēlu). Tāpat šajā pētījumā tika konstatēts absolūto neitrofilo leikocītu skaita (ANC) ātrāks un ilgstošāks pieaugums lipegfilgrastima grupā, salīdzinot ar pegfilgrastima grupu, kas norāda, ka mPEG piesaistei filgrastima molekulā, kā arī PEGilēšanas metodes izvēlei ir būtiska nozīme filgrastima biopieejamības uzlabošanā. [5; 8]
![Atšķirības plazmas koncentrācijā starp lipegfilgrastim un pegfilgrastim veseliem brīvprātīgajiem [8]](https://cdn.doctus.lv/media/2014/03/2/original/78de0f9698a8.jpg)
![Atšķirības plazmas koncentrācijā starp lipegfilgrastim un pegfilgrastim veseliem brīvprātīgajiem [8]](https://cdn.doctus.lv/media/2014/03/2/original/78de0f9698a8.jpg)
4. attēls
Atšķirības plazmas koncentrācijā starp lipegfilgrastim un pegfilgrastim veseliem brīvprātīgajiem [8]
Vai šīs atšķirības konstatē arī apstākļos, kad augstāk minētie medikamenti salīdzināti savā starpā, mazinot smagu neitropēniju iepriekš neārstētām krūts vēža pacientēm pēc masīvas (60 mg/m2 doksorubicīna hidrohlorīds + 75 mg/m2 docetaksels) ķīmijterapijas? Salīdzinot dažādu devu (3 mg, 4,5 mg, 6 mg) lipegfilgrastima injekcijas ar pegfilgrastima 6 mg injekciju, tika konstatēts, ka smagas neitropēnijas ilgums 4,5 mg lipegfilgrastima (vidējais ± SD 0,84 ± 1,05 dienas) un 6 mg pegfilgrastima (vidējais ± SD 0,87 ± 0,99 dienas) grupā būtiski neatšķīrās. Tomēr 6 mg lipegfilgrastima ievadīšana 24 stundas pēc ķīmijterapijas nodrošināja labāku efektivitāti smagas neitropēnijas ilguma mazināšanā pirmā cikla laikā (vidējais ± SD 0,76 ± 1,10 dienas) ar pegfilgrastima 6 mg injekcijas ievadīšanu 24 stundas pēc ķīmijterapijas (skat. 5. attēlu). [8]
![Atšķirības ANC starp lipegfilgrastim un pegfilgrastim pacientēm ar krūts vēzi [8]](https://cdn.doctus.lv/media/2014/03/2/original/e8a1d26e9ba2.jpg)
![Atšķirības ANC starp lipegfilgrastim un pegfilgrastim pacientēm ar krūts vēzi [8]](https://cdn.doctus.lv/media/2014/03/2/original/e8a1d26e9ba2.jpg)
5. attēls
Atšķirības ANC starp lipegfilgrastim un pegfilgrastim pacientēm ar krūts vēzi [8]
Pētījumā, kurā piedalījās II-IV stadijas krūts vēža pacientes, 24 stundas pēc ķīmijterapijas pusei pacienšu ievadīja 6 mg lipegfilgrastima, otrai pusei 6 mg pegfilgrastima. Tika konstatēts, ka nav statistiski ticamu atšķirību starp abām pētāmajām grupām attiecībā uz smagas neitropēnijas ilguma mazināšanu pirmā cikla laikā (p = 0,126), bet tika konstatētas statistiski ticamas atšķirības laikā, kas nepieciešams, lai absolūtais netrofilo leikocītu skaits atjaunotos (p = 0,0026). Lipegfilgrastima grupā tam bija nepieciešamas 5,9 dienas (vidējais ± SD 5,9 ± 3,4) bet pegfilgratima grupā 7,4 dienas (vidējais ± SD 7,4 ± 3,6). Lipegfilgrastims uzrādīja arī mazāku nepieciešamību pēc nākamās ķīmijterapijas devas atcelšanas vai samazināšanas. [8; 9]
PEGilēšanas ierobežojumi
Viens no ierobežojumiem ir iespēja vienādos reakcijas apstākļos iegūt dažādus izomērus, kam ir dažādas klīniskās īpašības, tāpēc iespējama ietekme uz medikamenta izvadīšanu no organisma, kā arī imunogenitāte - situācija, kad pret proteīnu var rasties organisma imūnā atbilde. Protams, uzlabojot tehnoloģiskos procesus (attīrīšanas metodes) un izvēloties vietas specifiskas PEGilēšanas metodes, no nevēlamajiem izomēriem iespējams atbrīvoties. [5]
Otrs ierobežojums saistīts ar to, ka, PEG pievienojot proteīna molekulai, būtiski pagarinās tā izvades laiks no organisma, jo salīdzinoši lielie proteīni un molekulas netiek izvadītas no nierēm, jo sevišķi situācijās, kad kopējā molekulmasa pārsniedz 60 kDA, kā arī PEG klātbūtne proteīnā 3-5 reizes palielina hidrodinamisko tilpumu. Tad iespējama proteīna uzkrāšanās aknās, izraisot "makromolekulāro sindromu". [2] Tāpēc klīnikā izmantoto savienojumu molekulmasa parasti nepārsniedz 40 kDA, lai gan ir izņēmumi, piemēram, methoxy polyethylene glycol-epoetin beta. [10]
Trešais ierobežojums saistīts ar proteīnu izmainīto struktūru, kad pazeminās konkrētam proteīnam specifiskā aktivitāte. Tomēr parasti šo situāciju labo tas, ka, pievienojot PEG, būtiski pagarinās proteīna noārdīšanās un cirkulācijas laiks, kas atsver ne tik lielo aktivitāti, jo proteīna aktivācija notiek tikai brīdī, kad tas savienojas ar attiecīgo receptoru. [8; 10]
Ceturtais ierobežojums saistīts ar finansēm. Viss mūsu dzīvē kļūst dārgāks, arī medicīnā, par katru uzlabojumu allaž jāpiemaksā. Uzlaboti bioloģiskie medikamenti parasti izmaksā dārgāk nekā iepriekšējās paaudzes medikamenti, tomēr atsevišķos gadījumos, piemēram, lipegfilgrastims nav dārgāks par pegfilgrastimu. [11]
Kopumā bioloģisko medikamentu PEGilēšanai ir būtiskas priekšrocības, salīdzinot ar tādiem pašiem nePEGilētiem medikamentiem!