Divas galvenās plazmas lipīdu formas ir triglicerīdi un holesterīns (brīvā un esterificētā formā). Lai būtu iespējams šo hidrofobo vielu transports asins plazmā, tie ir saistīti ar proteīnu, veidojot lipoproteīna kompleksu (1. attēls). Tieši no virsmas proteīna daļas (apolipoproteīna) ir atkarīgs, vai konkrētais cirkulējošais lipoproteīns būs aterogēns. Ikdienas klīniskajā praksē visbūtiskākie un arī laboratorijas analīzēs nosakāmie apolipoproteīni ir ApoB, ko satur visas zināmās uzskaitītās aterogēnās daļiņas, un ApoA1, ko satur augsta blīvuma lipoproteīnu holesterīns (ABLH), kas ir antiaterogēns.
Īsumā par lipīdu vielmaiņu
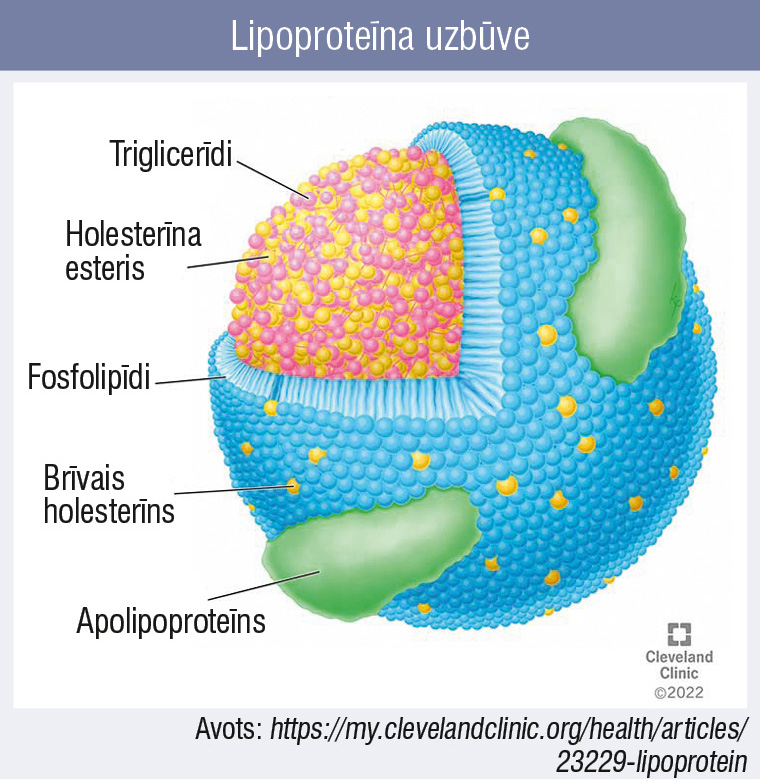

1. attēls
Lipoproteīna uzbūve
Ar uzturu uzņemtie lipīdi pēc sašķelšanas tievo zarnu lūmenā un nonākšanas tievo zarnu enterocītos tiek pārvērsti jeb “iepakoti” hilomikronos, kas caur limfātisko cirkulāciju tiek nogādāti asinsritē (2. attēls). Lipoproteīnu lipāze, kas atrodas kapilāru endotēlija virsmā, šķeļ hilomikronus — no triglicerīdiem atšķeltās brīvās taukskābes nonāk taukaudos un skeleta audos, bet “atlikušās” hilomikronu daļiņas jeb remnanti tiek transportēti uz aknām, kur hepatocītos, izmantojot no hilomikronu remnantiem turpmāk atdalītās taukskābes un holesterīnu, veikta de novo lipoģenēze un izveidotas ļoti zema blīvuma lipoproteīnu holesterīna (ĻZBLH) daļiņas, kas nokļūst asinsritē.
Pēc atkārtotas saskares ar kapilāru endotēlija virmas lipoproteīnu lipāzi, atdalot vēl atlikušās brīvās taukskābes, tiek iegūtas vispirms vidēji zema blīvuma lipoproteīnu holesterīna (VBLH) daļiņas un, turpinot taukskābju atšķelšanu, visbeidzot zema blīvuma lipoproteīnu holesterīna (ZBLH) daļiņas.
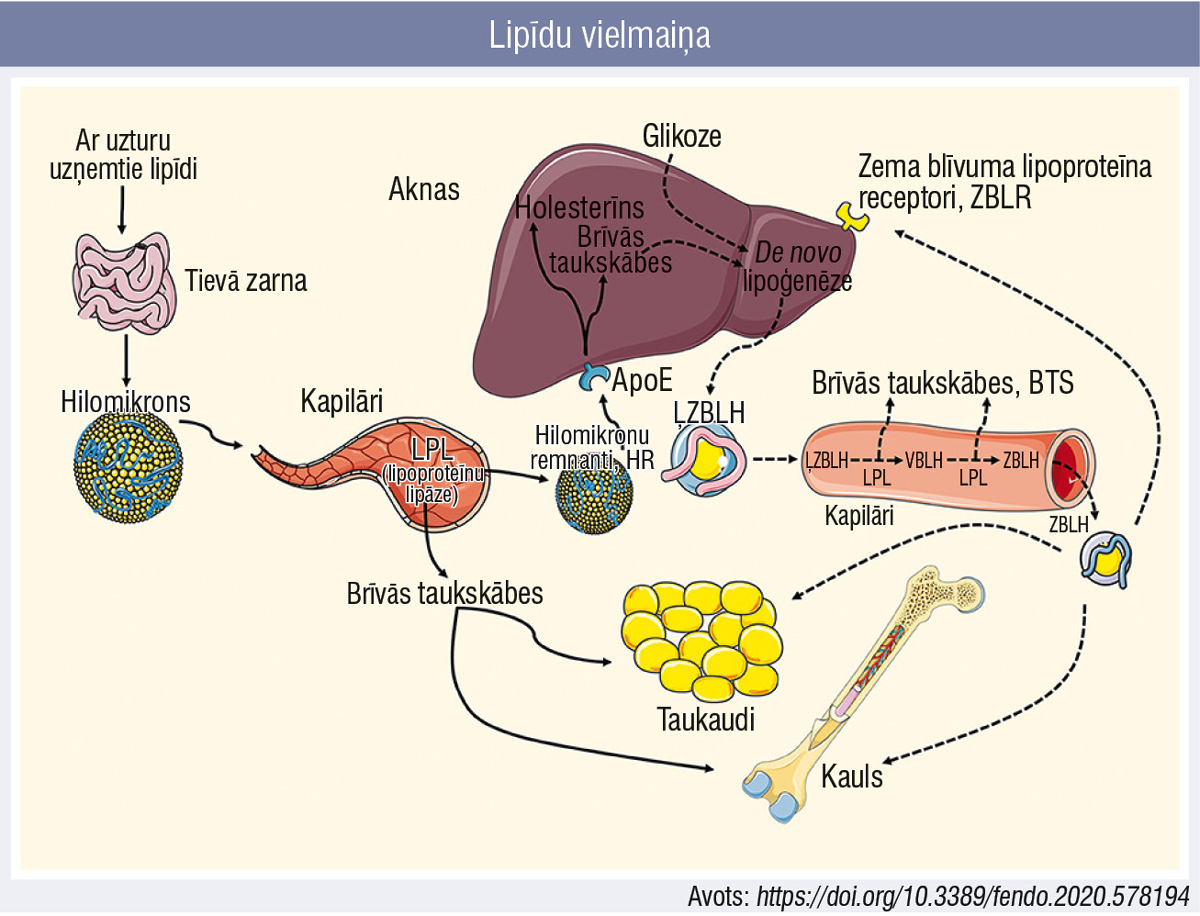

2. attēls
Lipīdu vielmaiņa
Lipidogramma
Cirkulējošo daļiņu aterogenitāti nosaka gan virsmas apolipoproteīna B klātiene (to satur hilomikroni, hilomikronu remnanti, ļoti zema, vidēja un zema blīvuma lipoproteīnu holesterīns), gan daļiņas izmērs (3. attēls).
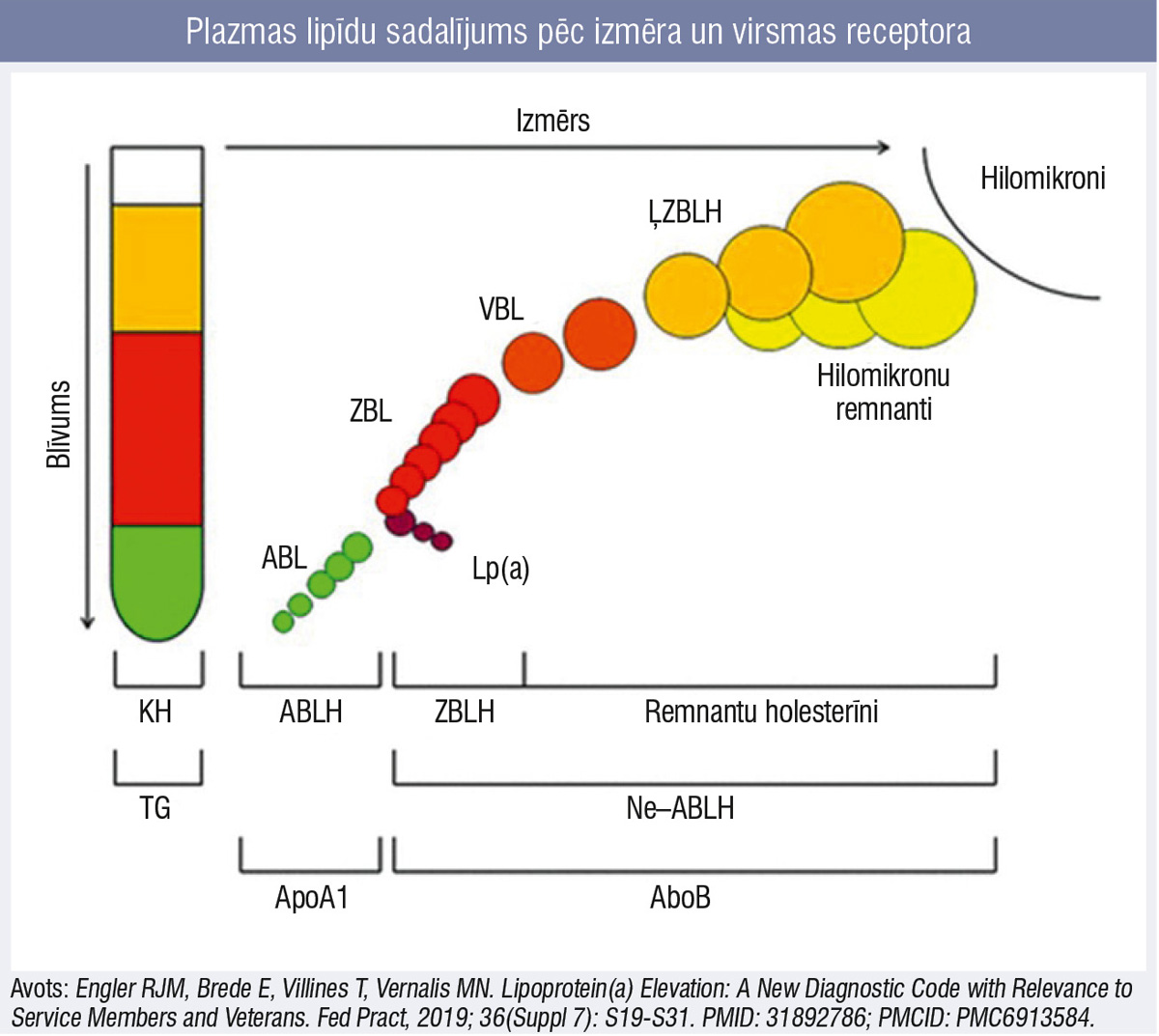

3. attēls
Plazmas lipīdu sadalījums pēc izmēra un virsmas receptora
Lielā izmēra dēļ ne hilomikroni, ne lielākās ĻZBLH daļiņas nespēj penetrēt endotēlija sieniņā un izraisīt aterosklerotiskās pangas veidošanos, bet to spēj visas pārējās mazāka izmēra daļiņas, kas secīgi veidojušās, atšķeļot taukskābes no iepriekšējām formām. Lai noteiktu aterogēno daļiņu apjomu, papildus standarta lipidogrammai pieejams arī ApoB mērījums.
Kā redzams shēmā, no kopējā holesterīna līmeņa atņemot ABLH līmeni, tiek iegūts t.s. ne–ABLH līmenis jeb visu daļiņu, kas satur aterogēno ApoB, līmenis. Savukārt, no ne–ABLH līmeņa atņemot ZBLH līmeni, iegūstam apjomu, ko veido remnanti no šķeltajiem hilomikroniem un ĻZBLH. Visi šie parametri ir tieši vai matemātiska aprēķina rezultātā nosakāmi lipidogrammā (4. attēls: piemērā sniegta nosūtījuma forma no E. Gulbja laboratorijas).
Kopējā holesterīna rādītājs ietver summu no ZBLH, ABLH un 20 % no triglicerīdu apjoma ar triglicerīdiem bagātajos ĻZBLH, VBLH un, ja asinis analīzei nav ņemtas tukšā dūšā, — arī hilomikronu remnantos. Ne–ABLH un remnantu holesterīna līmenis tiek aprēķināts matemātiski.
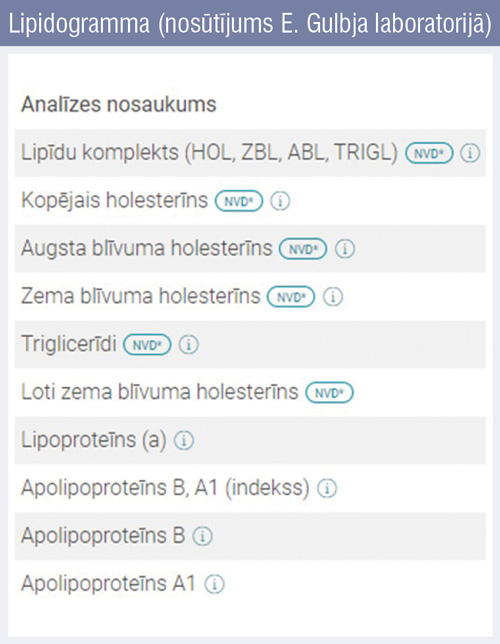

4. attēls
Lipidogramma (nosūtījums E. Gulbja laboratorijā)
ApoB un ApoA1 rādītāji nosaka konkrētā virsmas apolipoproteīna klātieni, kur ApoA1 būtībā dublē ABLH parametru, bet ApoB ietver visas aterogēnās daļiņas, kas ne vienmēr tieši korelēs ar mums pierasto standarta riska parametru ZBLH.
Lipidogrammas izvērtēšana klīniskos piemēros
Vēlos parādīt divus klīniskos piemērus, kur taktikas izvērtēšanai nepieciešama dažādas izvērstības pakāpes lipidogramma.
Pirmais piemērs (5. attēls): pacients ar zināmu, klīniski noteiktu ģimenes hiperholesterinēmiju. Šajā gadījumā ir izteikti augsts ZBLH, tātad per se proporcionāli augsts arī ne–ABLH.
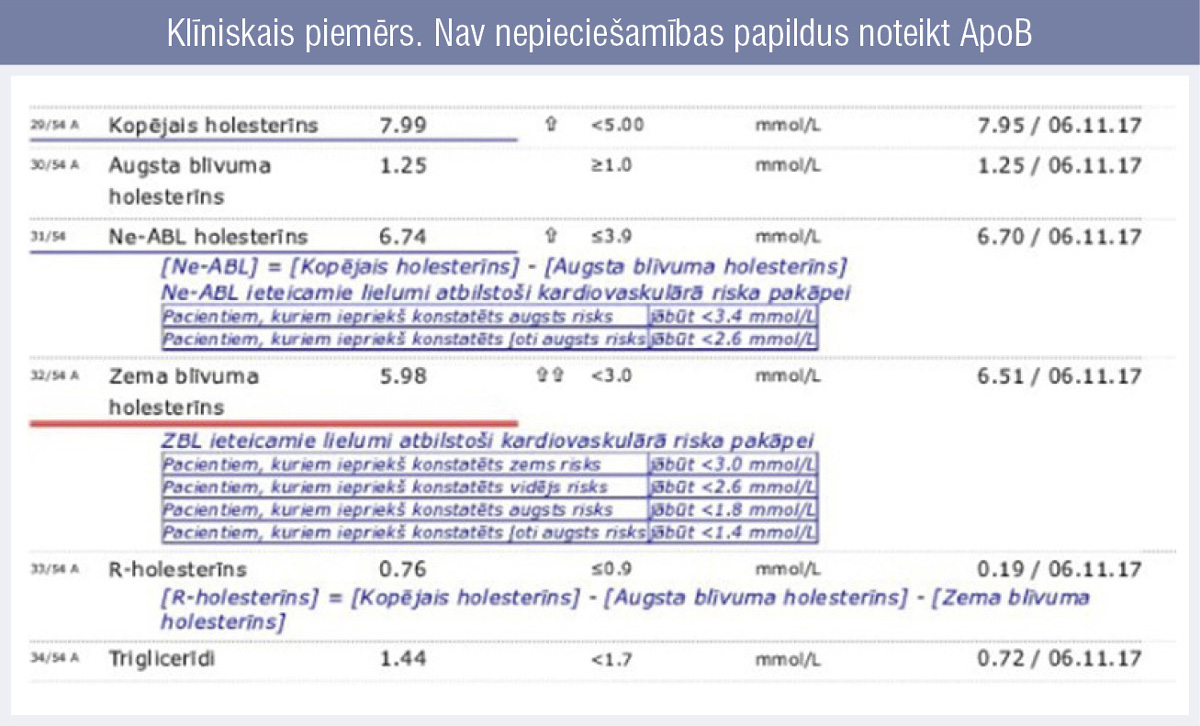

5. attēls
Klīniskais piemērs. Nav nepieciešamības papildus noteikt ApoB
Konkrētajā gadījumā, no KH atņemot ABLH un ZBLH līmeni, matemātiski iegūtais remnantu līmeni ir normāls, tātad pacienta problēma ir tikai ZBLH. Ja salīdzinām remnantu holesterīna līmeni abās izmeklējuma reizēs, redzams, ka tas korelē ar triglicerīdu līmeni: jo zemāks noteiktais triglicerīdu līmenis, jo zemāks līmenis no hilomikroniem un ĻZBLH (triglicerīdiem bagātās daļiņas).
Konkrētajā gadījumā nav mērķtiecīgi papildus noteikt arī ApoB rādītāju, jo skaidrs, ka tas būs proporcionāli tikpat virs normas, cik jau konstatētais ZBLH.
Otrais piemērs (6. attēls): pacients ar prevalējošu hipertrigliceridēmiju. Anamnēzē un klīniski nav datu par citiem riska faktoriem, tātad rekomendētais optimālais ZBLH līmenis < 2,6 mmol/l — un aktuāli noteiktais ir ļoti tuvu tam. Ja vērtētu izolēti tikai ZBLH līmeni, piemēram, ja šis būtu vienīgais noteiktais lipīdu parametrs, varētu kļūdaini secināt, ka pacientam no lipīdu puses riska faktoru nav. Atšķirībā no pirmā piemēra, kur paaugstināts bija ne–ABLH līmenis, bet normāls remnantu daudzums ar normālu triglicerīdu līmeni, šajā gadījumā līdz ar paaugstinātu triglicerīdu līmeni daudz ir arī remnantu — tātad cirkulācijā paralēli relatīvi normālam ZBLH daudzumam atrodas nozīmīgi palielināts cits aterogēno daļiņu skaits.


6. attēls
Klīniskais piemērs. ApoB līmenis būs paaugstināts
Ja konkrētajā gadījumā tiktu noteikts ApoB līmenis, tas būtu paaugstināts galvenokārt uz remnantu daļiņu rēķina.
Lipoproteīna (a) vieta un loma
Vispirms nozīmīgi zināt, ka lipoproteīna (a) analīze nav analogs iepriekš minētajām ApoA1 un ApoB analīzēm, bet līdzīgo nosaukumu dēļ nereti rada pārpratumus.
Daļa no ZBLH holesterīna satur papildu virsmas receptoru — apolipoproteīnu (a), un šīs apo(a) daļiņas saturošie ZBLH ir tas, ko laboratorijas analīzē nosaka kā parametru “lipoproteīns (a)”. Tā kā pamatā tā ir ZBLH daļiņa, tad, kā jau iepriekš minēts, tā satur arī ApoB un pieder pie aterogēnās saimes un mazā izmēra dēļ spēj penetrēt zem endotēlija (7. attēls). Apolipoproteīna daļa (a) sastāv no virknē sakārtotiem glikoproteīniem, kas pēc struktūras ir līdzīgi plazminogēnam, tātad ar protrombotisku un antifibrinolītisku darbību. Apo(a) sintēze notiek hepatocītos, un to veidojošo glikoproteīnu virkņu garums ir ģenētiski noteikts, tāpēc šis ir neatkarīgs kardiovaskulārā riska faktors.
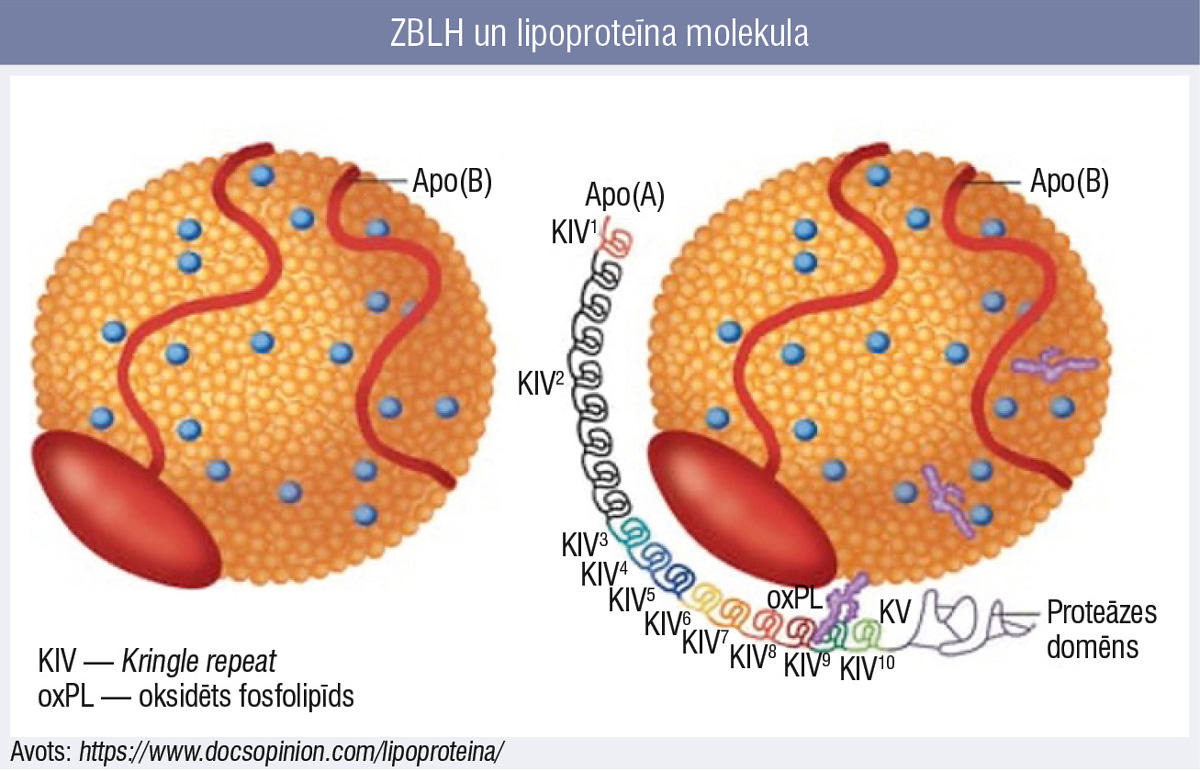

7. attēls
ZBLH un lipoproteīna molekula
Rutīnas lipodigrammā lipoproteīns (a) nokļuvis salīdzinoši nesen. Līdz 2019. gadam, kad nāca klajā šobrīd jaunākās Eiropas Kardiologu biedrības dislipidēmiju korekcijas vadlīnijas, šo rādītāju uzskatīja par mērķtiecīgu noteikt tikai specifiskos gadījumos, proti, zināmas ģimenes hiperholesterinēmijas vai agrīnas, smagas un ar citiem riska faktoriem neizskaidrojamas aterosklerotiskas slimības gadījumā. Šobrīd pēc daudzu plašu epidemioloģisku un ģenētisku pētījumu rezultātiem, kas norāda no devas atkarīgu lineāru sakarību starp lipoproteīna (a) koncentrāciju un aterosklerotiskas slimības attīstību, Eiropas Aterosklerozes biedrība
2022. gadā laidusi klajā konsensus dokumentu par lipoproteīnu (a) kā neatkarīgu kauzālu faktoru gan aterosklerozes, gan aortas vārstuļa stenozes attīstībā. Būtiski, ka paaugstināts lipoproteīna (a) līmenis uzskatāms par riska faktoru arī situācijās, kad ZBLH līmenis ir zems.
Noteikšana, uzraudzība un korekcijas iespējas
Lipoproteīna (a) noteikšana šobrīd tiek rekomendēta reizi dzīvē katram. Tā kā lipoproteīna (a) koncentrācija ir ģenētiski noteikta, tā atkārtota mērīšana dinamikā nav pamatota, ja pacients veic dzīvesveida korekciju vai tiek sākta vai mainīta terapija ar statīnu un/vai ezetimibu. Šobrīd ikdienas praksē nav specifisku medikamentu ar indikāciju lipoproteīna (a) mazināšanai. Pēdējos gados, pateicoties izmaiņām kompensējamo zāļu sarakstā, pacientiem salīdzinoši pieejamāka kļuvusi PCSK9 modulējošā bioloģiskā terapija (evolocumabum, alirocumabum, inclisiranum). Lai gan pētījumos, kas pierādīja PCSK9 nozīmi ZBLH līmeņa un secīgi kardiovaskulāro notikumu mazināšanā, netika specifiski iekļauti un izdalīti pacienti ar augstu lipoproteīnu (a), ir zināms, ka PCSK9 lietošana ir saistāma ar lipoproteīna (a) līmeņa pazemināšanos par 15—30 %. Tātad, ja pacientam izejas datos ir zināms augsts lipoproteīna (a) līmenis un tiek lietota PCSK9 modulējoša terapija, šis šobrīd būtu vienīgais pamatotais iemesls rādītāju noteikt atkārtoti.
Ir plaši zināms teiciens “jo zemāk, jo labāk” attiecībā uz ZBLH korekciju, ko varētu izmantot arī attiecībā uz lipoproteīnu (a). Tā kā specifiska terapija šobrīd ikdienas praksē vēl nepastāv, atbilstošāk būtu lietot “jo augstāks, jo sliktāk”, tātad — jo augstāks šis rādītājs, jo agresīvākai jābūt visu citu koriģējamo riska faktoru modifikācijai.
2019. gada Eiropas Kardiologu biedrības vadlīnijas lipoproteīna (a) līmeni > 180 mg/dl (> 430 nmol/l) definē kā identisku kardiovaskulāro notikumu riskam heterozigotas ģimenes hiperholesterinēmijas gadījumā. No ikdienas praktiskā viedokļa šis fakts rada jautājumus, uz kuriem pagaidām nav konkrēti atbildēts. Ja ĢH gadījumā ir zināms, ka ZBLH mērķis augsta riska gadījumā ir < 1,8 mmol/l (ja vēl nav aterosklerotiskas slimības un nodrošināma primārā profilakse), tad rodas jautājums, vai lipoproteīns (a) > 180 mg/dl vielaikus ar ZBLH > 1,8 mmol/l per se ir indikācija lipīdu līmeni pazeminošai terapijai, un tas tiek atstāts klīnicista interpretācijai.
2022. gada Eiropas Aterosklerozes biedrības konsensus dokumentā norādītas jau striktākas robežšķirtnes, izmantojot pragmatisku principu iekļaut/izslēgt lipoproteīna (a) radīto papildu risku. Lipoproteīns (a) < 30 mg/d (< 75 nmol/l) tiek rekomendēts kā izslēdzošs kritērijs iespējamam papildu riskam, bet > 50 mg/dl (> 125 nmol/l) kā papildu risku apstiprinošs faktors. Savukārt t.s. pelēkā zona 30—50 mg/dl (75—125 nmol/l) atstāta klīnicista interpretācijai katra individuālā pacienta gadījumā.
Klīniskais gadījums
Piemēram sniegts klīniskais gadījums ar, iespējams, tieši paaugstināta lipoproteīna (a) līmeņa lomu smagas, agrīnas koronāras sirds slimības attīstībā. Senākā dokumentētā lipidogramma veikta pacienta 52 gadu vecumā 2018. gadā (8. attēls, labajā pusē).
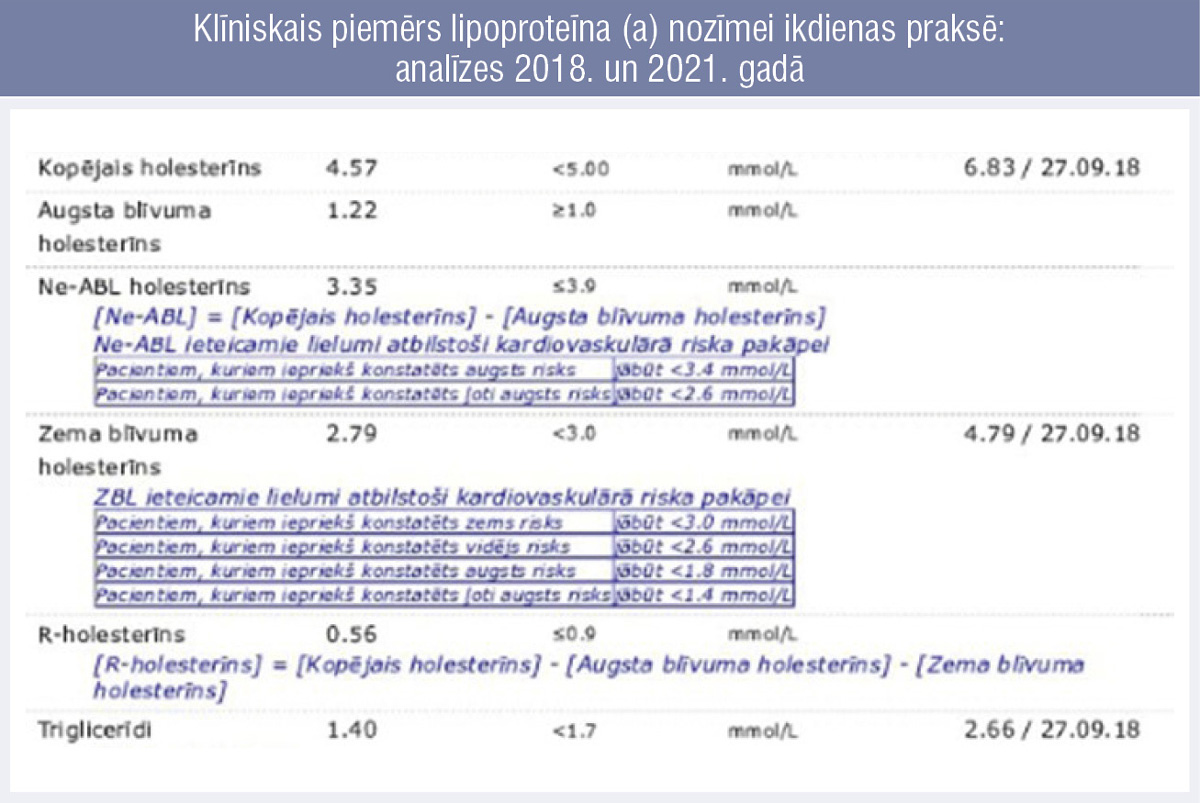

8. attēls
Klīniskais piemērs lipoproteīna (a) nozīmei ikdienas praksē: analīzes 2018. un 2021. gadā
Redzams, ka tolaik laboratorija vēl nepiedāvāja matemātiski kalkulēto ne–ABLH un remnantu līmeņa noteikšanu uzskatāmākai aterogēno daļiņu klātienes norādīšanai, taču no parametriem skaidrs, ka pacientam ir dislipidēmija, kas jākoriģē. Citu zināmu riska faktoru — tādu kā ģimenes anamnēze, arteriāla hipertensija, glikozes regulācijas traucējumi, smēķēšana — pacientam nebija, kā arī tobrīd nebija atbilstošu sūdzību, kas rosinātu veikt papildu izmeklējumus.
Nozīmēta lipīdu līmeni pazeminoša terapija ar statīnu un kontroles analīzes, kas datētas 2021. gadā: lipīdu rādītāji, ZBLH atbilst tam, kas tika uzskatīts par sasniedzamo mērķi pacientam ar šķietami zemu risku. Šajā pašā gadā 55 gadus vecajam pacientam — bez tipiskām koronāra rakstura sūdzībām, bet ar nedaudz mazāku slodzes panesību — tiek veikta veloergometrija, kas uzrāda mēmo išēmiju un secīgi koronarogrāfijā konstatēta trīs artēriju slimība un veikta koronāra šuntēšana.


9. attēls
Klīniskais piemērs lipoproteīna (a) nozīmei ikdienas praksē: analīzes 2023. un 2024. gadā
Sekundārajai profilaksei pacients lieto maksimālās statīna un ezetimiba devas, 9. attēlā jaunāka lipidogramma, kur redzams, ka ar šo terapiju konkrētajā gadījumā panākamais ZBLH līmenis nav ļoti tālu no optimālā (attiecīgi 1,8 mmol/l, vēlamais < 1,4 mmol/l), taču, pastāvot nozīmīgi paaugstinātam lipoproteīna(a) līmenim, skaidrs, ka aterosklerotiskās slimības progresēšanas iespēja nav izslēgta. Diemžēl pacients neatbilst šā brīža kritērijiem valsts kompensētai PCSK9 modulējošai terapijai (tā pienāktos, ja ZBLH pārsniegtu 3 mmol/l, lai gan tiek lietota kombinācija no maksimāli tolerējamās statīna devas un ezetimiba).