Kaulu vielmaiņas bioķīmisko marķieru nozīme osteoporozes pacientu aprūpē
Kaulu vielmaiņas bioķīmisko marķieru izmantošanas mērķis
Kaulu vielmaiņas bioķīmiskos marķierus nosaka, lai izvērtētu kaulu lūzumu risku, terapijas efektivitāti pacientiem specifiskas osteoporozes terapijas laikā un lai izvērtētu perorālo medikamentu absorbcijas traucējumus, palielinātu pacientu līdzesību un t.s. "medikamentu brīvdienu" laikā noskaidrotu kaulu vielmaiņas stāvokli. [1] Salīdzinot ar staru diagnostikas metodēm (t.sk. KMB (kaulu minerālais blīvums) noteikšanu osteodensi-tometrijā), BTM noteikšana ir neinvazīvs, drošs un arī salīdzinoši lēts izmeklējums. BTM noteikšana līdz ar citiem osteoporozes izraisītu lūzumu riska faktoriem var palīdzēt gan lūzumu riska, gan terapijas sākšanas laika noteikšanā. BTM noteikšana norādīta daudzu valstu vadlīnijās (skat. 1. tabulu). 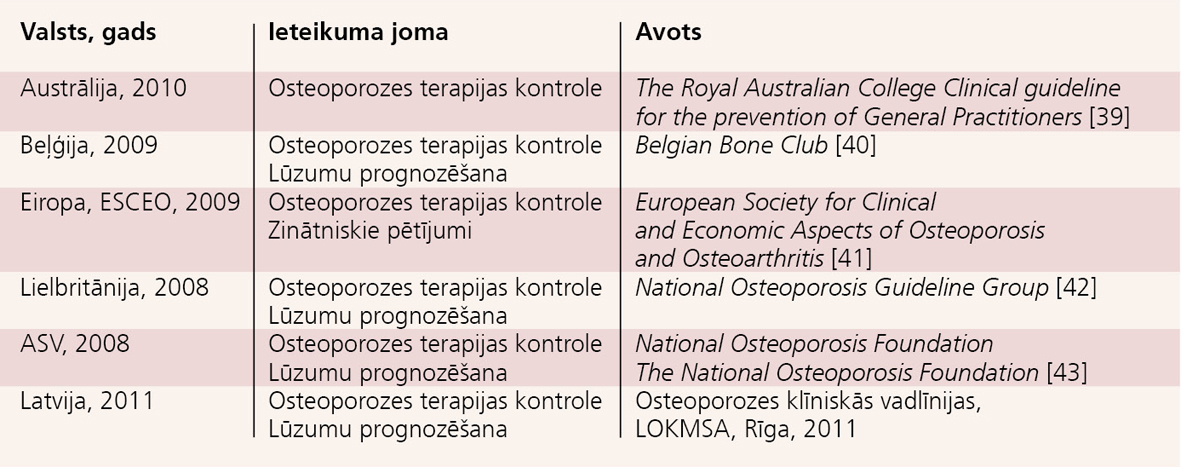

Lai gan KMB noteikšanai ir liela nozīme osteoporozes diagnostikā, tas nav vienīgais osteoporozes izraisītu lūzumu riska faktors. KMB dod iespēju noteikt pacientu grupu, kam lūzumu risks ir nopietnāks. Lūzumu risks jānosaka katram pacientam individuāli. Pašreiz pasaulē to pieņemts veikt ar FRAX kalkulatora palīdzību (http://www.shef.ac.uk/FRAX). Nosakot lūzumu risku, var izvērtēt specifiskās osteoporozes terapijas nepieciešamību. BTM ir arī papildu faktors lēmuma pieņemšanai par terapijas sākšanu ar osteoporozes medikamentiem vai to turpināšanu, vai citās retākās klīniskās situācijās. [1]
BTM veidi
BTM iedala divās grupās []:
- kaulu resorbcijas marķieri;
- kaulveides marķieri.
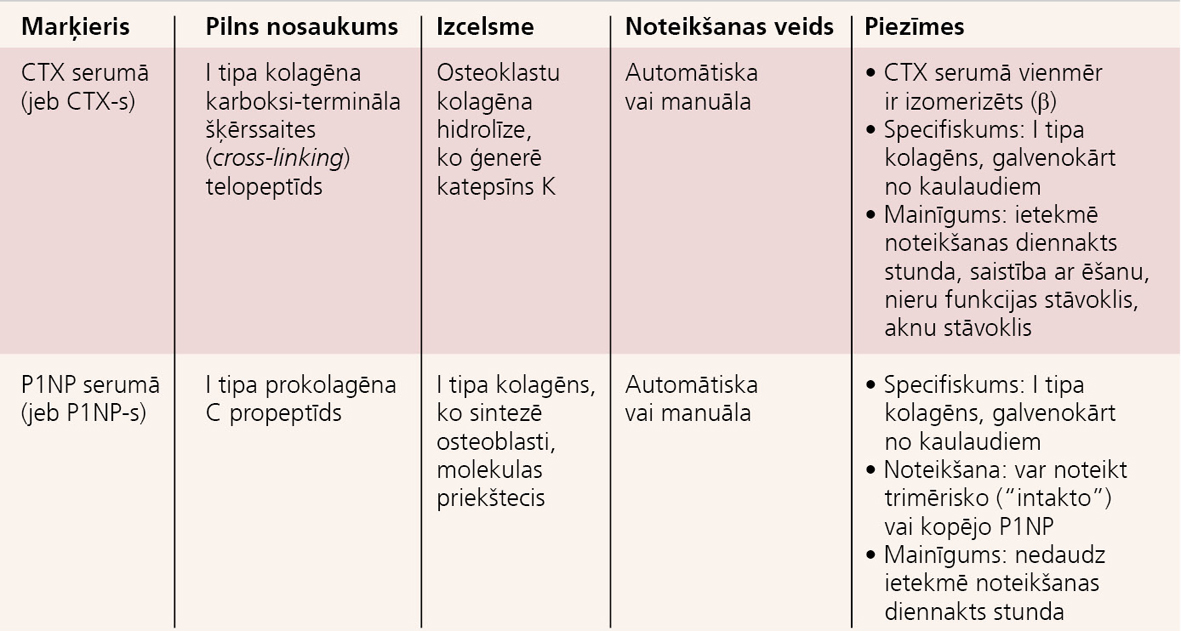
Kaulveides marķieri ir tieši vai netieši osteoblastu aktivitātes produkti dažādās osteoblastu attīstības fāzēs un ataino osteoblastu aktivitāti. I tipa kolagēns ir svarīgs kaulu matrices komponents, ko osteoblasti sekretē kā prokolagēna prekursoru kaulaudu veidošanās laikā. Prokolagēna molekulas sintēzes beigās pēc kaulu matrices izveides, uz kuru iedarbojušies enzīmi, tās molekulas nonāk asins cirkulācijā. Osteoblastos kaulveides laikā veidojas arī osteokalcīns, kura fragmenti izvadās ar urīnu. Jaunizveidotais osteoīds iziet nobriešanas un mineralizācijas fāzei, un šajā laikā osteoblasti sekretē sārmaino fosfatāzi ekstracelulārā šķidrumā un to var noteikt asinīs. Veseliem cilvēkiem tikai 50% sārmainās fosfatāzes izcelsme ir kaulaudi. Specifiskāka ir sārmainās fosfatāzes kaulu frakcija. Visbiežāk lietotie BTM ir I tipa kolagēna degradācijas produkti. Arī peptīdi CTX un NTX, kas ir I tipa kolagēna molekulas sastāvā, nonāk asinsritē un pēc tam ekskretējas urīnā. Kaulveides marķieri serumā:
- sārmainā fosfatāze (jeb ALP) un tās kaulu frakcija (jeb BALP);
- osteokalcīns (jeb OC);
- I tipa prokolagēna N-propeptīds (jeb P1NP);
- I tipa prokolagēna C-propeptīds (jeb P1CP).
Kaulu resorbcijas marķieri serumā:
- tartrātrezistentā skābā fosfatāze (jeb TRACP serumā);
- I tipa kolagēna karboksi-termināla šķērssaites (cross-linking) telopeptīds (jeb CTX serumā);
- I tipa kolagēna amino-termināla šķērssaites (cross-linking) telopeptīds (jeb NTX serumā);
Kaulu resorbcijas marķieri urīnā:
- deoksipiridinolīns (jeb DPD);
- piridinolīns (jeb PYD);
- I tipa kolagēna karboksi-termināla šķērssaites (cross-linking) telopeptīds (jeb CTX urīnā);
- I tipa kolagēna amino-termināla šķērssaites (cross-linking) telopeptīds (jeb NTX urīnā).
 2. tabulaBTM – nomenklatūra, saīsinājumi un apraksts
2. tabulaBTM – nomenklatūra, saīsinājumi un apraksts
Saskaņā ar Starptautiskā Osteoporozes fonda (International Osteoporosis Foundation jeb IOF) 2011. gada rekomendācijām [] kaulu vielmaiņas atsauces marķieri ir šādi:
- I tipa prokolagēna N-propeptīds serumā jeb P1NP, kas ir kaulveides marķieris;
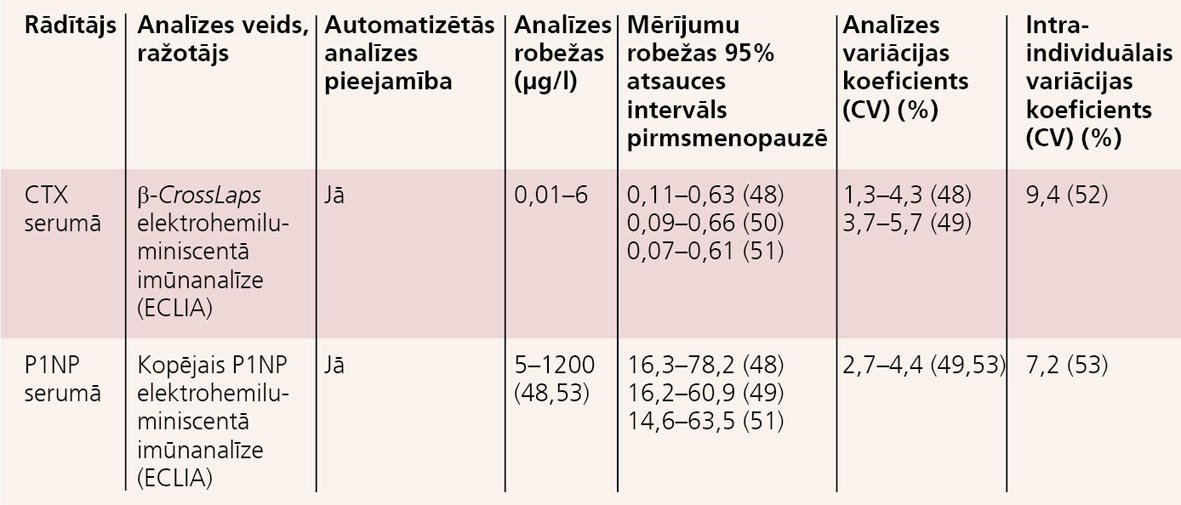
- I tipa kolagēna karboksi-termināla šķērssaites (cross-linking) telopeptīds jeb CTX, kas ir kaulu resorbcijas marķieris (skat.2. un 3. tabulu).
 3. tabulaCTX un P1NP izmaiņas un klīniskā darbība
3. tabulaCTX un P1NP izmaiņas un klīniskā darbība
CTX noteikšana serumā
Viens no kaulu vielmaiņas atsauces marķieriem ir CTX. Tas atspoguļo lineāru β-CTX I tipa kolagēna sadalīšanos. Kolagēns ir galvenais kaulu matrices komponents (90%). Šā marķiera noteikšanai izmanto I tipa kolagēna degradācijas fragmentu (β-CTX), kas satur β izomerizēto oktapeptīdu (EKAHD (β) GGR). [] Seruma peptīds var dot krusteniskas reakcijas ar dažām antivielām, kam ir liels molekulārais svars. [] Neviens no I tipa kolagēna degradācijas produktiem nav specifisks kaulaudiem, t.sk. arī CTX. Jādomā, ka tomēr lielākās CTX daļas avots ir kaulaudi. Šobrīd ir vairākas automatizētas imūnķīmiskas CTX noteikšanas metodes: β-Crosslaps Roche Elecsys 2010, Cobas e 411, Cobas e 602 (ECLIA, Roche Diagnostic, Vācija/ASV) un CTX-1 (CrossLaps) IDS-iSYS (CLIA, Immunodiagnostic Systems, Tyne and Wear, Lielbritānija). Lai gan abās metodēs izmantota imūnķīmiskā antivielu metode, vienam un tam pašam paraugam izmantojot abas metodes, konstatēta laba analīžu rezultātu korelācija, tomēr ir metodoloģiskas atšķirības. CTX rezultātu iespaido nieru funkcijas rādītāji, kā arī mainīgums diennakts laikā ar pīķi jeb maksimumu agrās rīta stundās un samazināšanos pēcpusdienā. Arī ēdiena uzņemšana iespaido mērījumu rezultātus - pēc ēšanas tie būs samazināti. [] Tāpēc analīzes jānodod no rīta tukšā dūšā. Vislabākā CTX stabilitāte konstatēta serumā vai plazmā, kam pievienots EDTA (skat. 2. un 3. tabulu).
P1NP noteikšana serumā
Otrs svarīgākais kaulu vielmaiņas atsauces marķieris ir P1NP. Tas ir peptīds, kas rodas, šķeļoties nenobriedušām prokolagēna molekulām kaula matrices sintēzes laikā. P1NP lielums atspoguļo visbagātāko kaulaudu proteīnu. Salīdzinot ar CTX, P1NP standartizācija ir mazāk izstrādāta. P1NP molekulārais svars ir 35 000 kDa. Neviens no I tipa formēšanās produktiem nav specifisks kaulaudiem, t.sk. arī P1NP. Jādomā, ka tomēr lielākās P1NP daļas avots ir kaulaudi. P1NP asinīs atrodas divu cirkulējošu formu veidos: kā "intakta" jeb trimēriska molekula un kā monomēriska molekula. [] Pašreizējās noteikšanas metodes nosaka tikai "intakto" jeb trimērisko formu vai abas formas kopā (jeb kopējo P1NP). Kopējā P1NP automātiskā noteikšana iespējama ar Elecsys (Roche Diagnostics, Vācija/ASV). "Intaktā" P1NP automātiskā noteikšana iespējama ar IDS-iSYS (Immunodiagnostic Systems). "Intakto" P1NP var noteikt arī radioimunoloģiski (UniQ P1NP RIA, Orion Diagnostica, Espoo, Somija). Lai gan P1NP noteikšanas rezultāti salīdzināmi ar relatīvi "veseliem" cilvēkiem ar osteoporozi un ar normālu nieru funkciju, taču ir heterogēna rezultātu iespējamība pacientiem ar hroniskām nieru slimībām vai metastātiskām kaulu slimībām, jo šo slimību gadījumos monomērie P1NP fragmenti var akumulēties (skat. 2. un 3. tabulu). [] P1NP noteikšanas priekšrocība ir nelielas diennakts svārstības un arī neliels starpindividuālais mainīgums. Tas ir stabils istabas temperatūrā. Noteikšana iespējama asins serumā vai plazmā. BTM izmaiņas aprakstītas zinātniskos pētījumos par visiem osteoporozes medikamentiem un lielos perspektīvos pētījumos: EPIDOS, OFELY, Dubbo Osteoporosis Study, MINOS, OPRA, MrOS (skat. 4. tabulu). 

CTX un P1NP noteikšanas praktiskie aspekti Latvijā
P1NP noteikšana serumā
Paraugu iesaka ņemt no rīta tukšā dūšā. Izmeklējamais materiāls - venozās asinis ar antikoagulantu (piemēram, Li-heparīns vai K3 EDTA). Parauga stabilitāte (ar heparīnu vai ar EDTA) 15-25ºC temperatūrā ir 24 stundas, 2-8ºC temperatūrā - 5 dienas, sasaldētai plazmai -20ºC temperatūrā pat 6 mēnešus. Analīzes metode: ECLIA (Roche Diagnostics).
Beta CTX noteikšana serumā
Paraugu iesaka ņemt no rīta tukšā dūšā. Izmeklējamais materiāls - venozās asinis ar antikoagulantu (piemēram, Li-heparīns vai K3 EDTA). Parauga stabilitāte plazmai ar heparīnu 15-25ºC temperatūrā ir 24 stundas, 4-8ºC temperatūrā - 8 dienas, bet sasaldētai plazmai -20ºC temperatūrā - 3 mēnešus. Parauga stabilitāte plazmai ar EDTA 15-25ºC temperatūrā ir 24 stundas, 4-8ºC temperatūrā - 8 dienas, bet sasaldētai plazmai -20ºC temperatūrā - 3 mēnešus. Analīzes metode: ECLIA (Roche Diagnostics). E. Gulbja laboratorijā abus kaulu vielmaiņas marķierus - P1NP un beta CTX - var noteikt katru darbdienu. Atbilde vienas dienas laikā.
Pacientu līdzesības kontrole terapijas procesā
Pacientu līdzestību perorālo osteoporozes medikamentu lietošanā pasaulē vērtē kā nepietiekamu, tā ir viena no biežākajām problēmām tieši gados vecākiem pacientiem. Līdzesības mazināšanās saistāma ar to, ka, piemēram, perorālo medikamentu lietošanā jāievēro īpaši noteikumi (stāvus, tukšā dūšā). Reizi nedēļā un reizi mēnesī lietojamie bisfosfonāti tikai nedaudz uzlabojuši līdzesību terapijai un persistenci. BTM noteikšana palīdz konstatēt pacientus, kam resorbcijas inhibēšana ir mazāka par teorētiski paredzamo. Tas nozīmē, ka pacientus, kas pārtrauc ieteikto ārstēšanu vai kas nav līdzestīgi ieteiktajam ārstēšanas režīmam, var atklāt ar BTM noteikšanas palīdzību. Tāpat ar BTM palīdzību var atklāt tos pacientus, kam ir patoloģiskas izmaiņas zarnu gļotādā un kam ir izmainīta aktīvo medikamentu absorbcija zarnās. BTM noteikšana šādos gadījumos jāveic pirms terapijas un vēlāk terapijas laikā, taču tas jāveic atsevišķos un pamatotos gadījumos (skat. 1. attēlu). ![Kaulu vielmaiņas marķieru izmantojuma algoritms osteoporozes ārstēšanas pārraudzībai [43-48]](https://cdn.doctus.lv/media/2012/09/2/original/497ef943d85b.jpg)
![Kaulu vielmaiņas marķieru izmantojuma algoritms osteoporozes ārstēšanas pārraudzībai [43-48]](https://cdn.doctus.lv/media/2012/09/2/original/497ef943d85b.jpg)
Osteoporozes ārstēšanas efekta monitorēšana
BTM noteikšana osteoporozes medikamentu terapeitiskās efektivitātes izvērtēšana ir nopietns uzdevums, un tai varētu būt liela klīniska nozīme. BTM izmaiņas (par 50% un vairāk) pēc antiresorbtīvo medikamentu terapijas sākšanas var atklāt jau pēc dažām nedēļām, turpretī KMB noteikšanu lielākoties rekomendē pēc viena vai diviem gadiem, un KMB izmaiņas šajā laikā visbiežāk ir nelielas - par 1-5%. BTM pozitīvi korelē ar terapeitisko atbildi visos "lielajos" ar osteoporozi saistītajos medikamentu pētījumos. [] Lai novērtētu BTM izmaiņas un lai tās atspoguļotu BTM īstenās izmaiņas jeb īsteno bioloģisko efektu, un lai izslēgtu gadījumus ar vienkāršām BTM izmaiņām jeb BTM svārstībām, piemēram, testa (metodes) variācijas koeficients jeb variācijas koeficients pārbaudes robežās ir 5%, taču katram individuālam pacientam BTM izmaiņām vajadzētu būt lielākām nekā 15-20%. Osteoporozes specifiskās terapijas laikā KMB izmaiņas 12 mēnešos ir relatīvi nelielas, tāpēc šo izmeklējumu ieteicams veikt ne agrāk kā pēc 12-24 mēnešiem, turpretī BTM izmaiņas ir agrīnas: izmaiņas rādītājos var atklāt jau 3-6 mēnešus pēc osteoporozes terapijas sākuma, ja BTM ir noteikti arī pirms terapijas.
Piemēri
Izvēloties perorālos bisfosfonātus to lietošanas sākumā, BTM jānovērtē pirms terapijas un pēc 3 mēnešiem, lai salīdzinātu ar sākotnējiem rādītājiem. BTM jāizvērtē arī 6 mēnešus pēc osteoporozes terapijas sākuma. [] Antiresorbtīvās terapijas mērķis ir pazemināt BTM līmeni un sasniegt tādus rādītājus, kādi ir premenopauzē, vai sa-sniegt tādus BTM rādītājus, kas ir pat mazāki nekā premenopauzē. Kaulu vielmaiņas marķieru izmantojuma algoritmu osteoporozes ārstēšanas efekta monitorēšanai skat. 1. attēlā. []
BTM nozīme osteoporozes ārstēšanas kontrolē
BTM izmaiņas osteoporozes ārstēšanas laikā pierādītas pētījumos. Pēc antiresorbtīvo medikamentu lietošanas sākšanas BTM samazinās, tādējādi atspoguļojot osteoklastu aktivitātes inhibīciju. []
Piemēri
Pēc intravenozo bisfosfonātu lietošanas sākuma konstatē kaulu resorbcijas marķieru samazināšanos jau dažas dienas pēc terapijas. Dažas nedēļas pēc perorālo bisfosfonātu lietošanas sākuma kaulu resorbcijas marķieri samazinās. [] Resorbcijas marķieru samazinājumam seko kaulveides marķieru samazinājums, kas sākotnēji ir straujš un pēc to maksimālās samazināšanās sasniedz plato (skat. 2. attēlu). [] ![Resorbcijas marķieru (CTX serumā) un kaulveides marķieru (P1NP serumā) izmaiņas terapijas laikā ar perorāli lietojamo alendronātu [39]](https://cdn.doctus.lv/media/2012/09/2/original/8691fee313c8.jpg)
![Resorbcijas marķieru (CTX serumā) un kaulveides marķieru (P1NP serumā) izmaiņas terapijas laikā ar perorāli lietojamo alendronātu [39]](https://cdn.doctus.lv/media/2012/09/2/original/8691fee313c8.jpg)
Pēc anabolo medikamentu (piemēram, teriparatīda) lietošanas kaulveides marķieri palielinās un sasniedz plato (skat. 3. attēlu). [] Lietojot stroncija ranelātu, osteoporozes medikamentu ar duālu darbību, kaulveides marķieri palielinās un kaulu resorbcijas marķieri samazinās. [] ![Resorbcijas marķieru (NTX urīnā) un kaulveides marķieru (P1NP serumā) izmaiņas terapijas laikā ar teriparatīdu [40]](https://cdn.doctus.lv/media/2012/09/2/original/bac05553b619.jpg)
![Resorbcijas marķieru (NTX urīnā) un kaulveides marķieru (P1NP serumā) izmaiņas terapijas laikā ar teriparatīdu [40]](https://cdn.doctus.lv/media/2012/09/2/original/bac05553b619.jpg)
BTM noteikšanas problēmas
Lai gan BTM noteikšana ir vienkārša un relatīvi neinvazīva, iespējams BTM bioloģiskais mainīgums, kura precizēšanai tiek lietotas dažādas metodoloģijas. Dažādu valstu vadlīnijās definētie BTM noteikšanas mērķi un klīniskie ieguvumi ir atšķirīgi (skat. 1. un 5. tabulu). 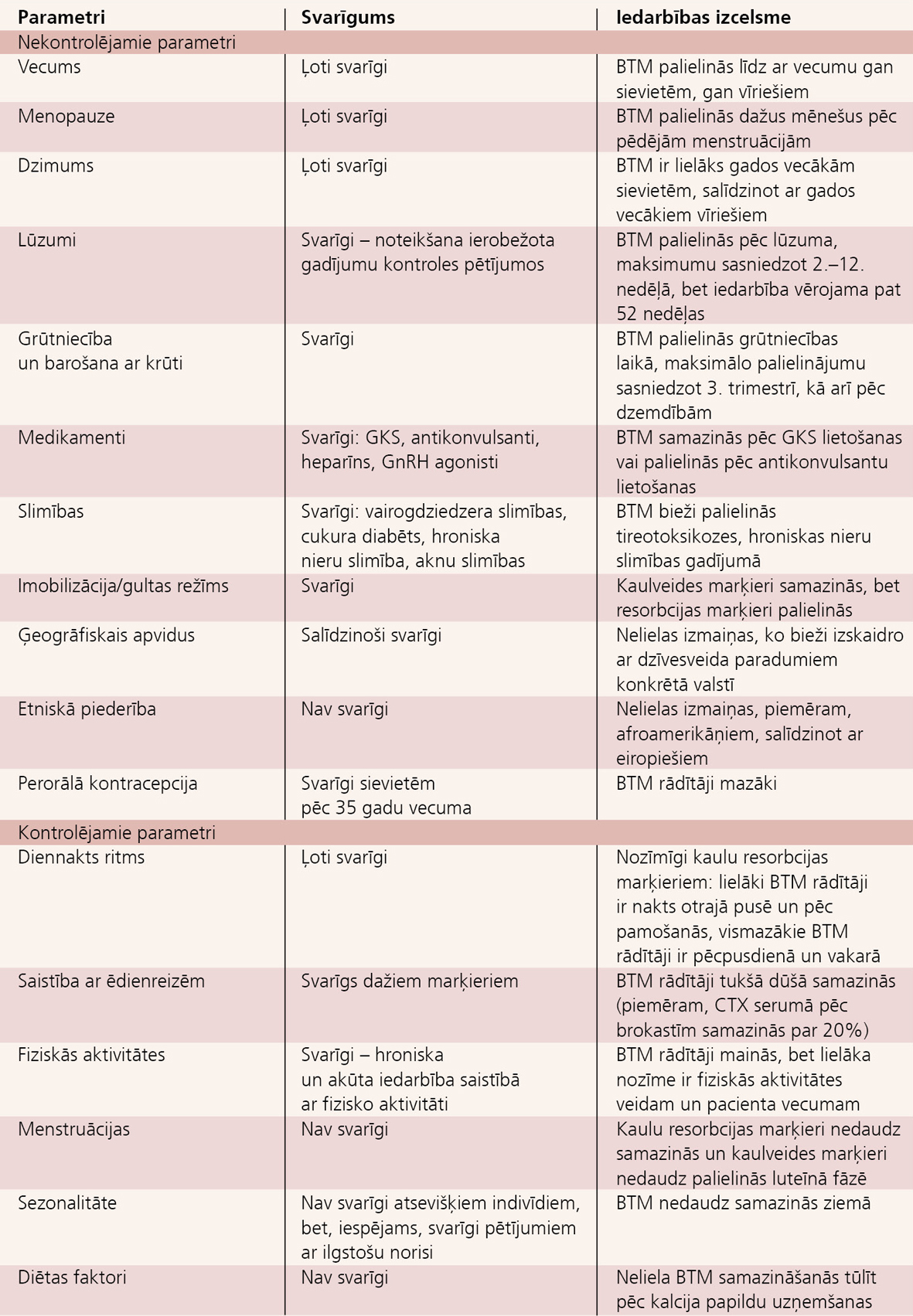

BTM līmenis liecina par lūzumu risku neatkarīgi no KMB [], bet to saistība ar citiem osteoporozes riska faktoriem vēl jānoskaidro pētījumos. Ir negatīva korelācija starp KMB un BTM, un šī korelācija ir lielāka un pārliecinošāka gados vecākiem pacientiem ar osteoporozi. Ārstēšana ar antiresorbtīviem medikamentiem sākotnēji samazina kaulu resorbcijas marķierus un vēlāk terapijas laikā samazina arī kaulveides marķierus. Ārstēšana ar anaboliem medikamentiem sākotnēji palielina kaulveides marķierus un vēlāk terapijas laikā - kaulu resorbcijas marķierus. [] Daudzos pētījumos pierādīta nozīmīga sakarība starp BTM antiresorbtīvo medikamentu lietošanas laikā un skriemeļu vai neskriemeļu lūzumu risku. [] Turpretī KMB izmaiņas notiek lēni, ir vidēji izteiktas un ne tik cieši korelē ar lūzumu risku kā BTM izmaiņas, it īpaši antiresorbtīvo medikamentu lietošanas laikā. [] BTM atkārtoti jāizvērtē pēc 3, 6 un 12 mēnešiem [], kā arī pacientiem, kas vēl nesaņem osteoporozes zāles, veicot sākotnējo laboratoro izmeklēšanu, un pacientiem "medikamentu brīvdienu" laikā. Par spīti tehnoloģiskajiem sasniegumiem BTM laboratoro metožu ieviešanā šobrīd šo marķieru bioloģiskais mainīgums un analizējamā materiāla mainīgums, kā arī standartizācijas problemātika aizkavē to plašu izmantošanu ikdienas klīniskajā praksē un paredzamo lūzumu riska noteikšanā. [] Taču, lai gan ir šie ierobežojumi, ārstu rokās ir jauns instruments ārstēšanas efekta un līdzestības uzlabošanā.
Literatūra
-
1. Kanis JA, Cooper C, et al. On behalf of the ESCEO. ESCEO, 2009.
2. Watts NB, Bilezikian JP, et al. AACE Postmenopausal Osteoporosis Guidelines 2010. Endocr Pract, 2010; 16 (Suppl. 3), Nov/Dec.
3. Tannenbaum C, Clark J, et al. Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab, 2002; 87: 4431-4437.
4. Barzel US. Recommended testing in patients with low bone density [with author reply]. J Clin Endocrinol Metab, 2003; 88: 1404-1405.
5. Papaioannou A, Morin S, et al. For the Scientific Advisory Council of Osteoporosis Canada. 2010 Clinical Practice Guidelines for the Diagnosis and Management of Osteoporosis in Canada: summary. CMAJ, 2010; Nov 23, 182 (17): 1864-1873.
6. Akesson K, Ljunghall S, et al. Assessment of biochemical markers of bone metabolism in relation to the occurrence of fracture: a retrospective and prospective population-based study of women. J Bone Miner Res, 1995; 10: 1823-1829.
7. Garnero P, Hausherr E, et al. Markers of bone resorption predict hip fracture in elderly women: the EPIDOS prospective study. J Bone Miner Res, 1996; 11: 1531-1538.
8. Gerdhem P, Ivaska KK, et al. Biochemical markers of bone metabolism and prediction of fracture in elderly women. J Bone Miner Res, 2004; 19: 386-393.
9. Ross PD, Kress BC, et al. Serum bone alkaline phosphatase and calcaneus bone density predict fractures: a prospective study. Osteoporos Int, 2000; 11: 76-82.
10. Sornay-Rendu E, Munoz F, et al. Identification of osteopenic women at high-risk of fracture: the OFELY study. J Bone Miner Res, 2005; 20: 1813-1819.
11. Van Daele PL, Seibel MJ, et al. Case-control analysis of bone resorption markers, disability, and hip fracture risk: the Rotterdam study. Br Med J, 1996; 312: 482-483.
12. Vergnaud P, Garnero P, et al. Under carboxylated osteocalcin measured with a specific immunoassay predicts hip fracture in elderly women: the EPIDOS study. J Clin Endocrinol Metab, 1997; 82: 719-724.
13. Meier C, Nguyen TV, et al. Bone resorption and osteoporotic fractures in elderly men: the Dubbo osteoporosis epidemiology study. J Bone Miner Res, 2005; 20: 579-587.
14. Arlot M, Meunier PJ, et al. Differential effects of teriparatide and alendronate on bone remodeling in postmenopausal women assessed by histomorphometric parameters. J Bone Miner Res, 2005; 20: 1244-1253.
15. Eastell R, Barton I, et al. Relationship of early changes in bone resorption to the reduction in fracture risk with risedronate. J Bone Miner Res, 2003; 18: 1051-1056.
16. Reginster J-Y, Sarkar S, et al. Reduction in P1NP, a marker of bone metabolism, with raloxifene treatment and its relationship with vertebral fracture risk. Bone, 2004; 34: 344-351.
17. Sarkar S, Reginster J-Y, et al. Relationship between changes in biochemical markers of bone turnover and BMD to predict vertebral fracture risk. J Bone Miner Res, 2004; 19: 394-401.
18. Bauer DC, Black DM, et al. Change in bone turnover and hip, non-spine, and vertebral fracture in alendronate-treated women: the fracture intervention trial. J Bone Miner Res, 2004; 19: 1250-1258.
19. Delmas PD, Munoz F, et al. The HORIZON-PFT Research Group. Effects of yearly zoledronic acid 5 mg on bone turnover markers and relation of P1NP with fracture reduction in postmenopausal women with osteoporosis. J Bone Miner Res, 2009; 24: 1544-1551.
20. Vasikaran S, Cooper C, et al. International Osteoporosis Foundation and International Federation of Clinical Chemistry and Laboratory Medicine. Position on bone marker standards in osteoporosis. Clin Chem Lab Med, 2011; 49(8): 1271-1274.
21. Compston JE, Cooper AL, et al. Guideline for the diagnosis and management of osteoporosis in postmenopausal women and men from the age of 50 years in the UK. Clinical guideline for prevention and treatment National Osteoporosis Guideline Group on behalf of the Bone Research Society, British Geriatrics National Osteoporosis Guideline Group on behalf of the Bone Research Society, British Geriatrics Society, British Orthopaedic Association, British Society of Rheumatology, National Osteoporosis Society, Osteoporosis Dorset, Primary Care Rheumatology Society, Royal College of Physicians and Society for Endocrinology. 2010; Updated July.
22. Glover SJ, Eastell R, et al. Rapid and robust response of biochemical markers of bone formation to teriparatide therapy. Bone, 2009; 45: 1053-1058.
23. Garnero P, Delmas PD. Biochemical markers of bone turnover in osteoporosis. // Marcus M, Feldman D, Kelsey J (eds.) Osteoporosis. 2nd ed. San Diego, CA: Academic Press, 2001; 2: 459-477.
24. Painter SE, Kleerekoper M, Camacho PM. Secondary osteoporosis: a review of the recent evidence. Endocr Pract, 2006; 12: 436-445.
25. Leslie WD, Tsang JF, Lix LM. Simplified system for absolute fracture risk assessment: clinical validation in Canadian women. J Bone Miner Res, 2009; 24: 353-360.
26. Brown JP, Albert C, et al. Bone turnover markers in the management of postmenopausal osteoporosis. Clin Biochem, 2009; 42: 929-942.
27. Koivula MK, Ruotsalainen V, et al. Difference between total and intact assays for N-terminal propeptide of type I procollagen reflects degradation of pN-collagen rather than denaturation of intact propeptide. Ann Clin Biochem, 2010; 47: 67-71.
28. Marin L, Koivula MK, et al. Comparison of total and intact aminoterminal propeptide of type I procollagen assays in patients with breast cancer with or without bone metastases. Ann Clin Biochem, 2011; 48: 447-451.
29. Garnero P, Shih WJ, et al. Comparison of new biochemical markers of bone turnover in late postmenopausal osteoporotic women in response to alendronate treatment. J Clin Endocrinol Metab, 1994; 79: 1693-1700.
30. Schlosser K, Scigalla P. Biochemical markers as surrogates in clinical trials in patients with metastatic bone disease and osteoporosis. Scand J Clin Lab Invest, 1997; Suppl., 227: 21-28.
31. Braga de Castro Machado A, Hannon R, Eastell R. Monitoring alendronate therapy for osteoporosis. J Bone Miner Res, 1999; 14: 602-608.
32. Bell NH, Bilezikian JP, et al. Alendronate increases bone mass and reduces bone markers in postmenopausal African-American women. J Clin Endocrinol Metab, 2002; 87: 2792-2797.
33. Greenspan SL, Parker RA, et al. Early changes in biochemical markers of bone turnover predict the long-term response to alendronate therapy in representative elderly women: a randomized clinical trial. J Bone Miner Res, 1998; 13: 1431-1438.
34. Garnero P, Gineyts E, et al. Different effects of bisphosphonate and estrogen therapy on free and peptide-bound bone cross-links excretion. J Bone Miner Res, 1995; 10: 641-649.
35. Rosen HN, Dresner-Pollak R, et al. Specificity of urinary excretion of cross-linked N-telopeptides of type I collagen as a marker of bone turnover. Calcif Tissue Int, 1994; 54: 26-29.
36. Rosen HN, Moses AC, et al. Utility of biochemical markers of bone turnover in the follow-up of patients treated with bisphosphonates. Calcif Tissue Int, 1998; 63: 363-368.
37. McClung MR, Lewiecki EM, et al. Denosumab in postmenopausal women with low bone mineral density. NEJM, 2006; 354: 821-831.
38. Foged N, Delaissé J, et al. Quantification of the collagenolytic activity of isolated osteoclasts by enzyme-linked immunosorbent assay. J Bone Miner Res, 1996; 11: 226-237.
39. Eisman J, Ebeling P, et al. Clinical guideline for the prevention and treatment of osteoporosis in postmenopausal women and older men. The Royal Australian College of General Practitioners. 2010. www.racgp.org.au
40. Bergmann P, Body JJ, et al. Evidence-based guidelines for the use of biochemical markers ofbone turnover in the selection and monitoring of bisphosphonate treatment in osteoporosis: a consensus document of the Belgian Bone Club. Int J Clin Pract, 2009; 63: 19-26.
41. Kanis JA, Burlet N, et al. on behalf of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) (2008). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int, 2008; 19: 399-428.
42. National Osteoporosis Guideline Group. Osteoporosis clinical guideline for prevention and treatment executive summary. 2010. www.shef.ac.uk/NOGG
43. Dawson-Hughes B, Lindsay R, et al. Clinician’s guide to prevention and treatment of osteoporosis. National Osteoporosis Foundation. 2010. www.nof.org
44. Rosen C, Hochberg M, et al. Treatment with once-weekly alendronate 70 mg compared with once-weekly risedronate 35 mg in women with postmenopausal osteoporosis: a randomized double-blind study. J Bone Miner Res, 2005; 20: 141-151.
45. Black DM, Delmas PD, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. NEJM, 2007; 356: 1809-1822.
46. Cummings SR, San MJ, McClung MR, et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. NEJM, 2009; 361: 756-765.
47. Bone HG, Bolognese MA, Yuen CK. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women. J Clin Endocrinol Metab, 2008; 93: 2149-2157.
48. Arlot M, Meunier PJ, et al. Differential effects of teriparatide and alendronate on bone remodeling in postmenopausal women assessed by histomorphometric parameters. J Bone Miner Res, 2005; 20: 1244-1253.
49. Glover SJ, Gall M, et al. Establishing a reference interval for bone turnovermarkers in 637 healthy, young, premenopausal women from the UK, France, Belgium, and the US. J Bone Miner Res, 2009; 24: 389-397.
50. Glover SJ, Gamero P, et al. Establishing a reference range for bone turnover markers in young, healthy women. Bone, 2008; 42: 623-630.
51. de Papp AE, Bone HG, et al. A cross-sectional study of bone turnover markers in healthy premenopausal women. Bone, 2007; 40: 1222-1230.
52. Adami S, Bianchi G, et al. On behalf of the BONTURNO study group. Determinants of bone turnover markers in healthy premenopausal women. Calcif Tissue Int, 2008; 82: 341-347.
53. Garnero P, Borel O, Delmas PD. Evaluation of a fully automated serum assay for C-terminal cross-linking telopeptide of type I collagen in osteoporosis. Clin Chem Lab Med, 2001; 47: 694-702.
54. Garnero P, Vergnaud P, Hoyle N. Evaluation of a fully automated serum assay for total N-terminal propeptide of type I collagen in postmenopausal osteoporosis. Clin Chem, 2008; 54: 188-196.