Kopš oktobra žurnālā Doctus esam snieguši informāciju par jaunumiem Eiropas Kardiologu asociācijas kongresā, kas no 30. augusta līdz 2. septembrim norisinājās klātienē Londonā un tiešsaistē. Šajā numurā apskatu noslēdzam ar nozīmīgu tēmu kardioloģisko pacientu aprūpē — hroniski koronāri sindromi (HKS), konspektīvi iepazīstinot ar jaunām vēsmām vadlīniju atjauninājumā. Svarīgākais — pacientu izvērtē un ārstē pakāpeniski, pa solim, lai izvairītos no nevajadzīgas diagnostikas un terapijas.
1. solis: pacienta sākotnējā novērtēšana
Šajā solī iekļauta anamnēzes ievākšana, fizikālā izmeklēšana, tātad standarta EKG un asins bioķīmija. Plaušu funkcijas izvērtēšana un krūškurvja Rtg dažkārt veicama atsevišķām pacientu grupām. Šo soli vada vai nu ģimenes ārsts, vai kardiologs.
Pēc pacienta izvērtēšanas iespējami trīs iznākumi.
- Pacienta simptomiem nav atrasts kardiāls iemesls un jāārstē cits simptomu iemesls → meklējam citu iemeslu.
- Pacientam ir tādi akūti simptomi kā nestabila stenokardija, sirds mazspējas dekompensācija vai aritmija un pacients ir hemodinamiski nestabils → jānodrošina neatliekamā palīdzība stacionārā.
- Joprojām ir aizdomas par HKS → turpinām izmeklēšanu.
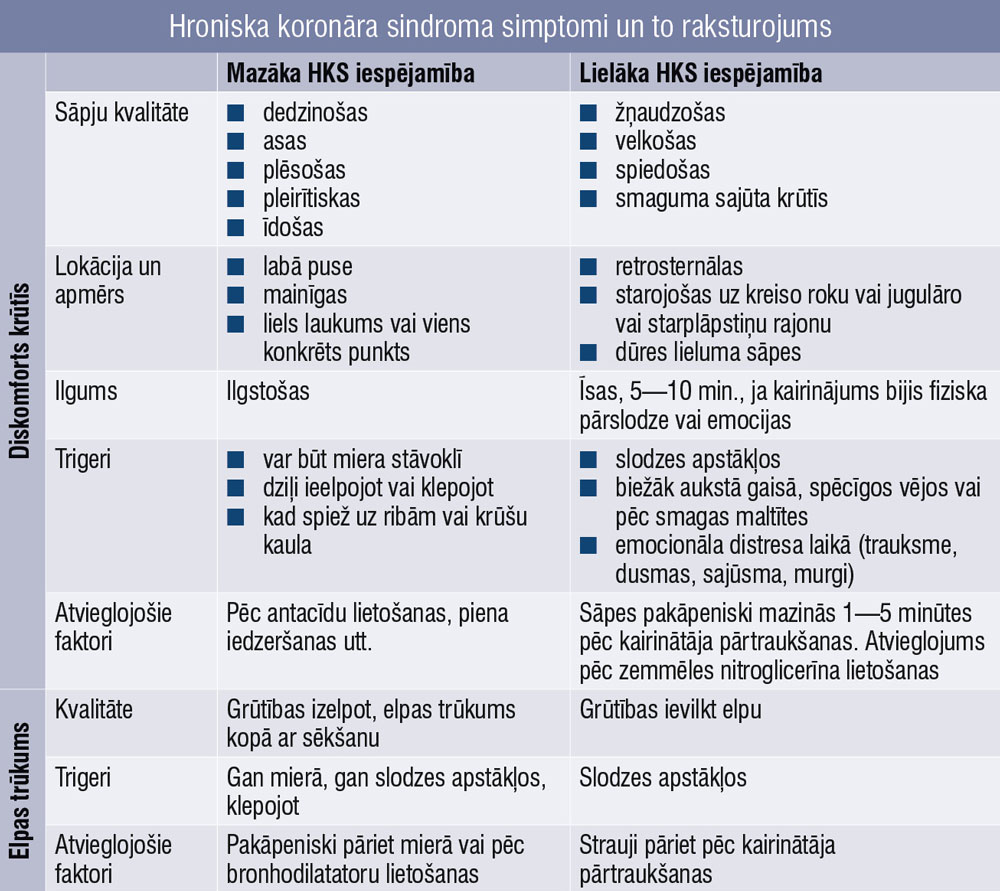

1. tabula
Hroniska koronāra sindroma simptomi un to raksturojums
Jāpievērš uzmanība tam, ka sāpes krūtīs nav vienīgais simptoms, kas kvalificējas aizdomām par HKS (tabula). Vēl interesanti, ka “tipiska” un “netipiska” stenokardija šā brīža HKS konceptā vairs netiek izskatīta kā pacienta stāvokli raksturojoša.
Šie termini jāaizstāj ar detalizētu simptomu aprakstu, iekļaujot potenciālos ekvivalentus sāpēm krūtīs.
2. solis: padziļināta izmeklēšana
Hroniskas koronāro artēriju slimības (KAS) iespējamību attiecīgajam pacientam izvērtējam, izmantojot riska faktoru izsvērtu klīniskās iespējamības modeli, un būtu jāveic EhoKG mierā un slodzes EKG jeb veloergometrija. Un atkal pēc šiem izmeklējumiem iespējami trīs dažādi iznākumi.
- Pacients tiek kvalificēts zema riska grupā ar ne vairāk kā 5 % iespējamību obstruktīvai KAS; apsveram tālāko izmeklēšanu atlikt, prātā paturot koronāras spazmas vai mikrovaskulāras disfunkcijas iespējamību.
- Pacientam ir smagas blakusslimības vai zema dzīves kvalitāte: apsveram tālāk neizmeklēt un ārstēt medikamentozi.
- Veicam nākamo soli.
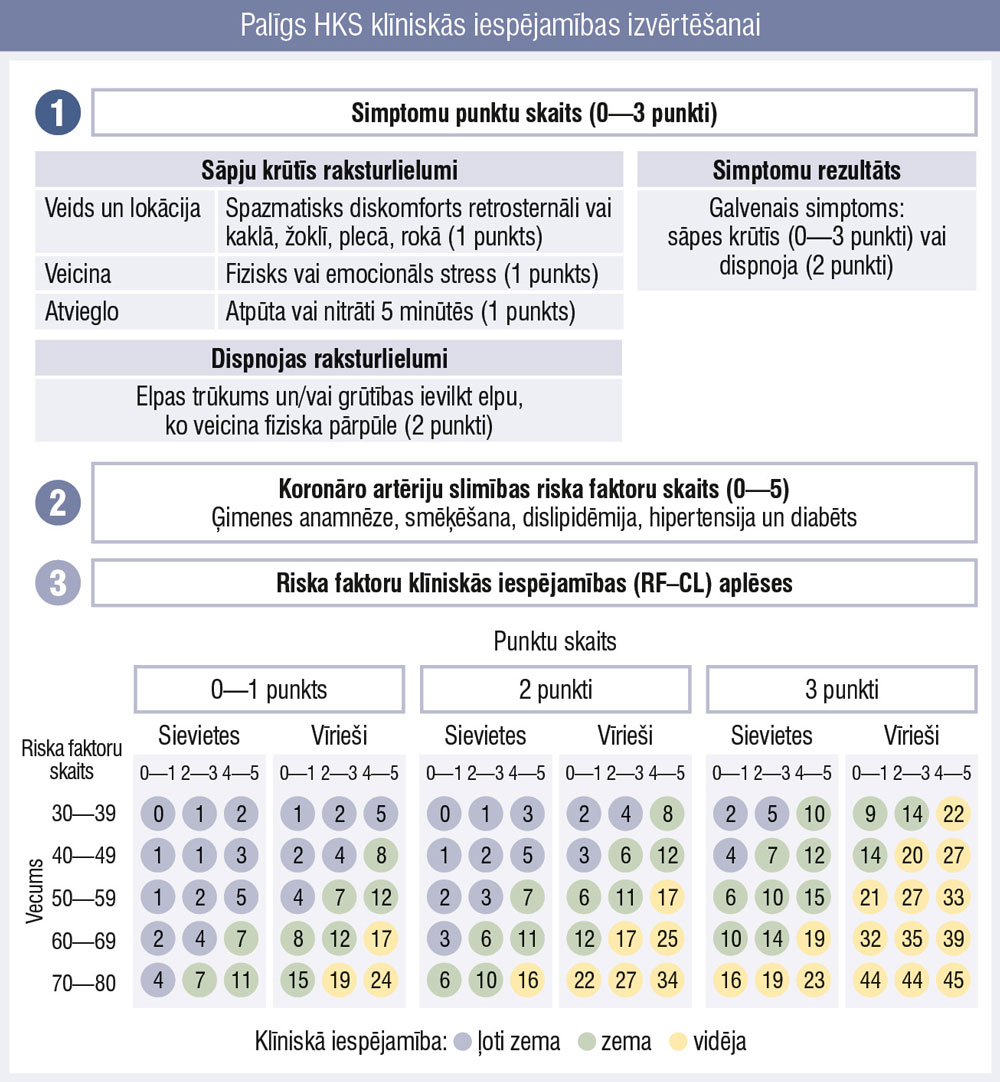

1. attēls
Palīgs HKS klīniskās iespējamības izvērtēšanai
Pirms pievēršanās nākamajam solim precizējam, ko īsti nozīmē riska faktoru skala un klīniskās iespējamības modelis, kas arī sastāv no trīs soļiem (1. attēls). Klīnicistam jāizvērtē pacienta simptomi, jāskaita riska faktori un trešajā solī jānovērtē klīniskas HKS iespējamība.
Turklāt pēc šīs izvērtēšanas informācija pielāgojama kvalitatīvā veidā pēc normālas klīniskās atrades (izmaiņas miera EKG, slodzes EKG, KK disfunkcija, ventrikulāra aritmija, perifēro artēriju slimība, koronāra kalcifikācija iepriekš veiktā krūšu DT). Visbeidzot jāapsver koronāro artēriju kalcija rādītāja (CACS) izmantošana pacientiem ar zemu klīnisko iespējamību (> 5—15 %), lai reklasificētu un neveiktu invazīvus izmeklējumus pacientam, kam būtībā tie nav nepieciešami un risks ir ļoti zems jeb ≤ 5 % (IIa klases rekomendācija).
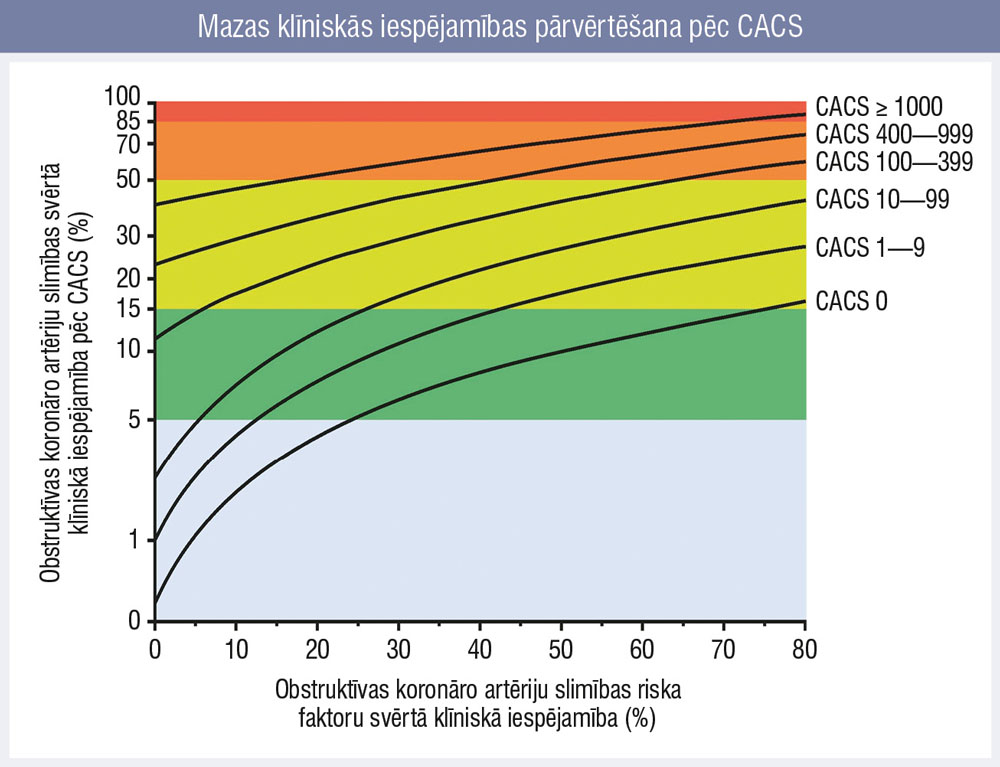

2. attēls
Mazas klīniskās iespējamības pārvērtēšana pēc CACS
Piemēram, ja pacientam ir 14 % iespējamība (zems risks) un CACS rādītājs 0, šo pacientu no zemas klīniskās iespējamības pārkvalificējam uz ļoti zema riska (zem 5 %) kategoriju (2. attēls), attiecīgi mainot taktiku tālākajā aprūpē un diagnostikā.
Ļoti zema riska pacientiem papildu izmeklējumus neveicam, bet ko darām ar pārējām pacientu grupām?
3. solis: apstiprinām diagnozi un novērtējam notikumu risku
Būtībā ir trīs pamata izmeklējumi — invazīva angiogrāfija, ja ir ļoti augsta klīniskā iespējamība (> 85 %), aizdomas par augsta riska obstruktīvu KAS, smagu miokarda išēmiju. Otrs variants — funkcionāli attēldiagnostikas veidi pacientiem ar vidēju un augstu (> 50—85 %) klīnisko iespējamību un CCTA (datortomogrāfijas angiogrāfija koronārajiem asinsvadiem) pacientiem ar zemu—vidēju (> 15—50 %) klīnisko iespējamību (3. attēls).
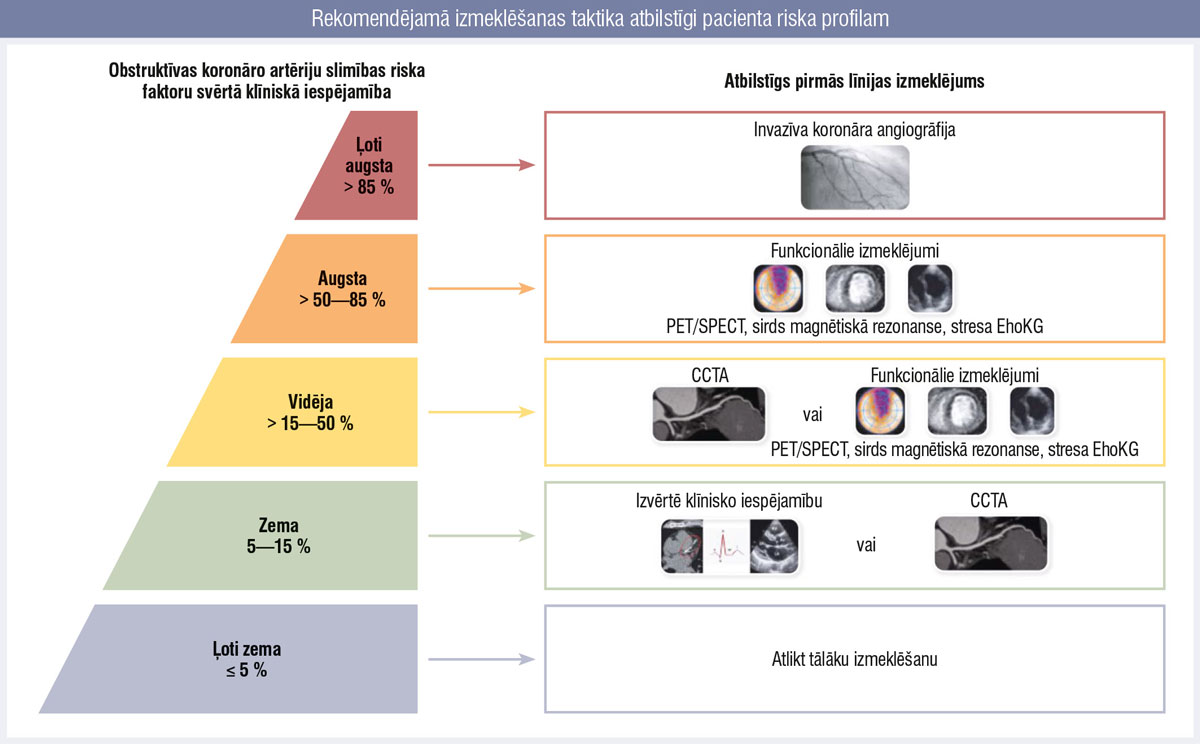

3. attēls
Rekomendējamā izmeklēšanas taktika atbilstīgi pacienta riska profilam
CCTA ievērojamā loma izsvērta vairākos pētījumos, īpaši SCOT–HEART, kas bija atvērta tipa paralēlu grupu daudzcentru pētījums par 4146 pacientiem ar stabilu stenokardiju, kuri nosūtīti pie kardiologa klīniskai izvērtēšanai. Pacienti tika iedalīti standarta aprūpei + CCTA vai tikai standarta aprūpei. Primārais pētījuma iznākums bija nāve no koronāras sirds slimības vai nefatāla miokarda infarkta nākamajos piecos gados: CCTA grupā 2,3 % pacientu, standarta grupā 3,9 % (HR 0,59; 95 % TI 0,41—0,84, p = 0,004). CCTA izmantošana uzlaboja pacientu klīnisko iznākumu salīdzinājumā ar to neizmantošanu.
4. solis: ārstēšana
Noslēdzošais solis iekļauj dzīvesveida un riska faktoru modifikāciju kombinācijā ar slimību modificējošiem medikamentiem. Bieži nepieciešama kombinācija ar antiangināliem medikamentiem, bet koronāru revaskularizāciju apsver, ja simptomi ir refraktāri, lai gan pacients lieto medikamentus, vai augsta riska KAS gadījumā. Ja simptomi saglabājas pēc obstruktīvas KAS izslēgšanas, jāapsver koronāras mikrovaskulāras slimības un/vai vazospazmas diagnoze.
Medikamenti, kas mazina simptomus
Svarīgākā izmaiņa jaunajās vadlīnijās par šo medikamentu klasi publicēta ar I C rekomendāciju līmeni: antianginālo zāļu terapiju rekomendēts pielāgot pacienta raksturlielumiem, blakusslimībām, citiem lietotajiem medikamentiem, panesībai un stenokardijas patofizioloģijai, tāpat jāņem vērā zāļu pieejamība un izmaksas.
Lai uzsvērtu elastīgāku un pielāgotāku pieeju pacientam individuāli, vadlīniju autori izvairās no pirmās līnijas vai otrās līnijas medikamentu nosaukšanas.
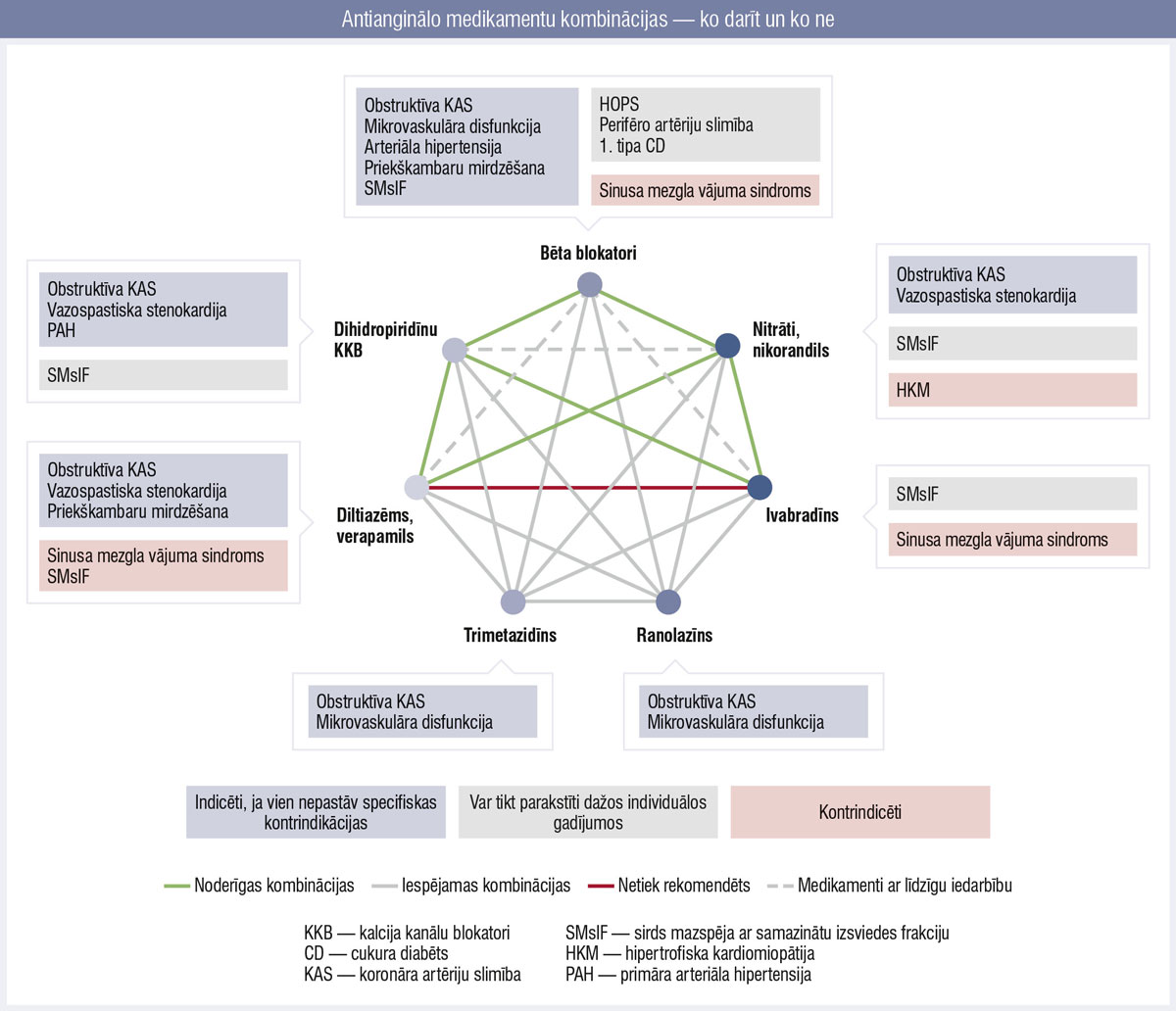

4. attēls
Antianginālo medikamentu kombinācijas — ko darīt un ko ne
Bez īsas darbības nitrātiem, kalcija kanālu blokatoriem un bēta blokatoriem tiek piedāvāti arī citi medikamenti, kas var mazināt simptomus (4. attēls). Vadlīnijās kā papildu terapija piedāvāta ilgas darbības nitrātu vai ranolazīna pievienošana terapijā pacientiem ar neadekvātu simptomu kontroli (saglabāta IIa/B rekomendācija), bet nikorandils un trimetazidīns pārcelti uz IIb/B rekomendāciju līmeni (iepriekš IIa/B).
Ivabradīnu var apsvērt kā papildu antianginālu medikamentu pacientiem ar KK sistolisku disfunkciju (KKIF < 40 %) un neadekvātu simptomu kontroli vai kā daļu iniciālās terapijas rūpīgi izraudzītiem pacientiem (IIa/B). Ivabradīns netiek rekomendēts pacientiem ar HKS, KKIF > 40 % un bez klīniskas SM (III B).
Medikamenti, kas uzlabo prognozi
Antitrombotiskā terapija
Jaunajās vadlīnijās saglabājas I A klases rekomendācija aspirīnam, bet pievienojusies arī jauna I A rekomendācija klopidogrelam — pacientiem ar HKS un MI anamnēzē vai pēc veiktas PCI kā droša un efektīva alternatīva aspirīna lietošanai monoterapijā ir rekomendēts klopidogrels 75 mg dienā. Šo rekomendāciju pamato tādi pētījumi kā HOST–EXAM par 5530 pacientiem 6—18 mēnešus pēc PCI ar DES.
Izteikta vēl viena jauna I klases rekomendācija (I B) pacientiem bez MI vai revaskularizācijas, bet ar pierādījumiem par nozīmīgu obstruktīvu KAS, proti, mūža ilgumā rekomendēts aspirīns 75—100 mg dienā. Par otra antitrombotiskā līdzekļa pievienošanu jāskatās vadlīnijās — publicēti plaši kritēriji, kad, kam un kādās devās.
Pacientiem pēc PCI ar HKS un bez indikācijām OAK — duāla antiagregantu terapija: aspirīns 75—100 mg un klopidogrels 75 mg × 1 dienā ne ilgāk kā sešus mēnešus rekomendēta kā standarta stratēģija pēc PCI stentēšanas (I A).
Duālā antiagregantu terapija pacientiem ar augstu asiņošanas risku, bet ne ar augstu išēmijas risku jāpārtrauc 1—3 mēnešus pēc PCI un pēc tam jāturpina monoterapija (I A).
Pacientiem, kam dažādu iemeslu dēļ jālieto antikoagulanti, piemēram, priekškambaru mirdzēšanas pacientiem, ar I A rekomendācijām sniegts pārskats, kas pauž: pēc nekomplicētas PCI pacientiem ar HKS un indikācijām lietot OAK:
- agrīni pārtraucam aspirīnu (1 nedēļā),
- turpinām OAK un klopidogrelu — līdz sešiem mēnešiem pacientiem ar ne–augstu išēmisko risku un līdz 12 mēnešiem pacientiem ar augstu išēmisku risku. Tālāk OAK tiek lietots monoterapijā, ja tā rekomendēts.
Lipīdu līmeni pazeminoša terapija
Lielākajai daļai pacientu anatomiskais substrāts ir ateroskleroze. Tāpēc likts uzsvars arī uz adekvātu lipīdu pārvaldību šiem pacientiem. Ar I B rekomendāciju kā jaunums šajās vadlīnijās minēts — ja pacientiem ir statīnu nepanesība un mērķis netiek sasniegts ar ezetimibu, rekomendēta kombinācija ar bempedoīnskābi. Un IIa/C rekomendācija — ja mērķi netiek sasniegti ar maksimālām statīna/ezetimiba devām, arī jāapsver bempedoīnskābes pievienošana.
Svaru mazinoša terapija
Jauna IIa/B rekomendācija ir par GLP1 receptoru agonistu semaglutīdu, ko apsver izmantot pacientiem ar virssvaru (ĶMI > 27 kg/m²) vai aptaukošanos pacientiem ar HKS bez diabēta, lai mazinātu KV mirstību, MI vai insulta risku, kas pierādīts pētījumā SELECT (n = 17 604).
Pretiekaisuma terapija
Interesanta jauna IIa/A līmeņa rekomendācija publicēta par kolhicīnu — HKS pacientiem ar aterosklerotisku KAS var apsvērt kolhicīna lietošanu mazā devā (0,5 mg dienā), lai mazinātu MI, insulta un revaskularizācijas risku. Ieteikumu pamato rezultāti no pētījumiem LoDoCo2 un COLCOT.
Noslēgumā
Mums ir droši un efektīvi medikamenti, taču tie iedarbosies tikai tad, ja zāles tiešām lietos, tāpēc pacienti jāizglīto, jāinformē par ieguvumiem un riskiem, jāveicina līdzestība
ilgtermiņā.
Un, protams, rūpīgi jāizvērtē katra pacienta individuālie riski, indikācijas papildu izmeklējumiem un jāizvēlas pareizākā terapijas shēma — no izmaiņām dzīvesveidā un medikamentozās terapijas līdz revaskularizācijai.
Der atcerēties par ANOCA un INOCA — jaunajās vadlīnijās šiem nebūt ne labdabīgajiem stāvokļiem pievērsts daudz vairāk uzmanības nekā iepriekš — šie pacienti reti kad tiek korekti diagnosticēti un netiek nozīmēta viņiem pielāgota terapija, kas pasliktina viņu dzīves kvalitāti, veicina atkārtotu hospitalizāciju un izmeklēšanu.
Kardiologu viedoklis
Dr. D. Sondore: “Vislielākais izaicinājums ir nelīdzestīgi pacienti.”
Šobrīd Latvijā HKS pacientu grupa ir ļoti dažāda un mainīga. No 40 gadu vecuma tie pārsvarā ir vīrieši, no 50 gadu vecuma sāk dominēt arī sievietes, turklāt šajā grupā biežāk izpaužas INOCA, ANOCA diagnozes. Tās mainās atbilstoši pacienta līdzestības pakāpei. Joprojām stacionārā parādās pirmreizēji pacienti ļoti cienījamā vecumā ar pirmreizēju AKS, bet jau smagu trīs artēriju slimību, kas līdz šim nav saņēmuši nekādu terapiju, kad vairs nav iespējams veikt pilnīgu revaskularizāciju, bet tikai paliatīvu ļoti augsta riska revaskularizāciju.
Vissmagākā ir tā pacientu grupa, kurai ir KSS ar kreisā kambara disfunkciju un ar zemu izsviedes frakciju. Pacienta stāvokli sevišķi pasliktina tādas pavadošās slimības kā cukura diabēts un nieru mazspēja.
Bet vislielākais izaicinājums ir nelīdzestīgi pacienti, kas paši mēģina internetā rast attaisnojumu tam, lai nelietotu, piemēram, statīnus vai citus medikamentus, mēģinot tos aizvietot ar nepierādītiem uztura bagātinātajiem. Arī daļēji līdzestīgie pacienti, kas paši reducē medikamentus devas vai lietošanas biežumu, nav pasargāti no nelabvēlīgiem klīniskiem notikumiem.
Vadlīniju ieviešana kardiologa rutīnā
Jebkurš kardiologs ikdienas praksē vispirms izmanto pirmos divus soļus: izvērtē simptomus, noskaidro visus riska faktorus un tad lemj, vai pacientu sūtīt tikai uz funkcionāliem vai attēldiagnostikas izmeklējumiem, uz VEM vai uzreiz uz CT koronarogrāfiju vai invazīvu izmeklējumu. Bieži redzam, ka negatīva VEM atbilde neizslēdz nozīmīgu KSS. Šobrīd punktu vērtēšanas sistēma praksē nav iegājusies, jo tā ir laikietilpīga, pacients jāvērtē atkārtoti, turklāt rindas pie speciālistiem ir garas. Terapija tiek sākta, kad diagnoze apstiprināta, turklāt jāinformē pacients, ka tā būs ilgstoša, daži medikamenti jālieto līdz mūža galam.
CACS jeb koronāro artēriju kalcija rādītājs ikdienas praksē
Kalcija daudzums CT izmeklējumā diemžēl ne vienmēr tiek noteikts, tas atkarīgs no konkrēta radiologa. Ja šis rādītājs ir noteikts, kardiologi to noteikti ņem vērā, jo pilnīgi veselās artērijās nekad nebūs kalcija, turklāt ir pietiekami daudz pētījumu, kas apliecina, ka CACS virs 400 saistīts ar ievērojami lielāku klīnisko notikumu, mirstības risku. Ja CACS virs 1000, noteikti jātaisa arī invazīvs izmeklējums, jo artefaktu dēļ CT nevar precīzi izvērtēt artēriju lūmenu.
Izmeklējumu taktika pēc vadlīniju algoritma un reālā situācija
PET ir ļoti dārgs izmeklējums, Latvijā nav pieejams, bet ir pieejama miokarda perfūzijas scintigrāfija (SPECT), uz kuru kardiologs sūta pacientus ar apšaubāmu VEM. Uz negatīvu VEM paļauties ne vienmēr ir droši, ja pacientam ir netipiskas sūdzības. Vislabāko aprūpi pacients saņem, kad izvērtēta koronārā anatomija, nevis veikti tikai funkcionālie izmeklējumi. Arī pacients, redzot savu asinsvadu stāvokli, kļūst motivētāks lietot medikamentus, līdzestība ilgtermiņā zūd retāk. Viena negatīva iezīme parādās, kad pacienti, zinot koronāro asinsvadu izmaiņas, pēc gada vēlas redzēt, vai dinamika ir negatīva vai pozitīva, tad ārstam pacients jāatrunā no nevajadzīgas atkārtotas invazīvas iejaukšanās.
Piekrītu, ka invazīvi izmeklējumi kā pirmā izvēle pārāk bieži tiek veikti nepamatoti, tas izskaidrojams ar to, ka uz CTA ir daudz garākas gaidīšanas rindas. Dažkārt kā papildu arguments invazīva izmeklējuma izvēlei ir fakts, ka pacienti, ejot uz izmeklējumu, ir satraukti, kas provocē tahikardiju vai pacientam ir biežas ektrasistoles, aritmijas, tad CTA izmeklējums neizdodas. Samazināts GFĀ būs iemesls, kāpēc CTA ambulatoriem pacientam tiks atteikta. Stresa ehokardiogrāfija mums ļoti palīdz, ja jau zināma pacienta anatomija ar robežstenozēm vai kādas artērijas oklūziju, lai saprastu, vai jāveic revaskularizācija vai pietiks ar to, ka turpinām tikai medikamentozo terapiju.
Kardiologs uz magnētisko rezonansi sūta pacientus, ja nepieciešama papildu informācija pēc transtorakālās ehokardiogrāfijas, lai izvērtētu miokarda struktūru, ne koronārās artērijas, diemžēl stresa magnētiskā rezonanse kā funkcionāls izmeklējums Latvijā ikdienas praksē nav brīvi pieejams.
Dr. R. Feders: “Svarīgi gan anatomiski, gan funkcionāli izmeklējumi!”
Pēc jaunākās hroniska koronāra sindroma definīcijas mēs arvien plašāku pacientu loku varam iekļaut šajā sindromā. Ņemot vērā diagnostisko metožu straujo attīstību, mēs agrīnāk spējam diagnosticēt kardiovaskulāras slimības. Tāpēc hroniska koronāra sindroma izplatība ir lielāka, bet grūti salīdzināt ar iepriekšējiem gadu desmitiem, jo pirms vairāk nekā desmit gadiem koronāru patoloģiju bieži vien diagnosticēja tikai pēc kardiovaskulāra notikuma, piemēram, infarkta. Šobrīd, attīstoties neinvazīvai koronārai diagnostikai, mēs laicīgāk diagnosticējam koronāru sirds slimību. Interesanti izaicinājumi parādās, interpretējot patoloģiskus funkcionālos izmeklējumus, piemēram, veloergometriju vai miokarda perfūzijas scintigrāfiju gadījumos, kad nav konstatētas izmaiņas epikardiālajos koronārajos asinsvados. Ir jāizšķir nepatiesi pozitīvi izmeklējumi no, piemēram, INOCA. Agrāk pēc koronarogrāfijas, kurā nav konstatētas koronāras stenozes, šie pacienti principā vairs netika izmeklēti. Tagad vairāk būtu jādomā par mikrovaskulāru disfunkciju, kas var būt šo patoloģisko izmaiņu iemesls. Aizdomām par INOCA tālāk būtu jāseko invazīvai diagnostikai ar mikrocirkulatoras pretestības indeksa un koronārās plūsmas rezerves noteikšanu, kā arī acetilholīna provokācijas testu. Vēl kā izaicinājums saglabājas pacienta pārliecināšana par medikācijas un prevencijas nozīmi pirms tam, kad pacients piedzīvojis infarktu vai kļuvis simptomātisks.
Vadlīniju ieviešana ikdienas kardiologa rutīnā
Manuprāt, vadlīnijas ir ļoti labi izveidotas un praktiskas jaunajiem ārstiem, jo ir ļoti lietderīgi vēlreiz definēt pamatlietas un noteikt soļus, kā risināt pacienta gadījumu.
Ārsti, kuri jau ilgi ārstē pacientus ar koronāru sirds slimību, šādu ceļa karti jau bija sev izstrādājuši.
Koronāro artēriju kalcija rādītājs ikdienas praksē
CACS var noteikt natīvā (bez kontrastvielas) sirds datortomogrāfijā. Tas veicams vienkārši. Jāatceras, ka jauniem pacientiem (< 40 gadus veciem) ar stenozējošu koronāru sirds slimību daudz biežāk ir Calcium Score 0 nekā vecāka gadagājuma pacientiem (60—69 gadus veciem). Vadlīnijās ieteikts Calcium Score noteikt pacientiem ar mazu pirmstesta iespējamību obstruktīvai koronārai slimībai, lai papildus nodrošinātos, ka garām netiek palaista nozīmīga patoloģija. Šis ieteikums man šķiet ļoti vērtīgs, jo diemžēl vēl arvien ir pacienti, kuriem ir nozīmīga patoloģija, bet kuri neklasificējas standarta riska rāmī. Piemēram, šķietami veseli pacienti, kas nesmēķē, kam nav klasisko kardiovaskulāro riska faktoru, bet ir nozīmīga koronāra stenoze.
Izmeklējumu taktika pēc vadlīniju algoritma un reālā situācija
Ikdienas praksē koronārajā diagnostikā joprojām nozīmīga ir ehokardiogrāfija un veloergometrija, šobrīd ļoti būtisku lomu pārņēmusi CCTA ar iespēju diagnosticēt koronāru sirds slimību un iegūt anatomisku priekštatu par koronārām artērijām, neveicot invazīvu izmeklējumu, kas samazina virkni risku. Tā ir ļoti pieejama metode, tiek veikta vairākos centros un spēj sniegt labu priekšstatu par koronārās sirds slimības anatomisko izpausmi. Šeit jāpiemin atšķirība starp funkcionāliem un anatomiskiem izmeklējumiem: funkcionāli izmeklējumi sniedz tikai priekšstatu par to, vai pacientam ir hemodinamiski nozīmīgas koronāras stenozes, tomēr funkcionāls izmeklējums var arī sniegt maldīgu priekšstatu, ka šim pacientam nav koronāras problēmas. Attiecīgi šis pacients biežāk izvēlēsies neārstēties, kaut terapija viņam ir indicēta. Piemēram, pacientam reizēm saku: iedomājieties, ja mēs CCTA diagnosticētu 50 % stenozes visos sirds asinsvados, jūs noteikti nopietnāk attiektos pret savu asinsspiedienu, holesterīna mazināšanu un arī aspirīna lietošanu nekā tad, ja mēs to nezinām. Funkcionālos izmeklējumos šādas 50 % stenozes var palaist garām, tāpēc pacients, iespējams, medikamentus nelietotu un neievērotu arī pārējās rekomendācijas. Ir svarīgi izvērtēt katru pacientu individuāli un plašāk veikt anatomiskos izmeklējumus. Tomēr jāņem vērā, ka funkcionālie izmeklējumi ieņem ļoti nozīmīgu lomu, īpaši jāizceļ stresa EhoKG, kas kļūst arvien vairāk pieejama, jo tai ir ļoti augsts jutīgums un specifiskums un pirms tās nav nepieciešama īpaša sagatavošanās. Tā varētu kļūt par izvēles metodi, lai pacientus uzraudzītu arī turpmāk. Nereti CCTA vai invazīvā koronarogrāfijā konstatējam mērenas stenozes, pacientiem tiek nozīmēta terapija: statīni, aspirīns, TA pārvaldība, bet pēc gada, diviem, pieciem... Katru gadu būtu jāspēj atbildēt pacientam uz jautājumu, vai šīs stenozes nav progresējušas un kļuvušas hemodinamiski nozīmīgas. Un šos pacientus lieliski var novērot ar stresa EhoKG palīdzību. Protams, ir arī miokarda perfūzijas scintigrāfija, kas ir salīdzinoši laba metode, bet komplicētāka un laikietilpīgāka.