Rakstā, kas publicēts Doctus 2024. gada septembra numurā, prof. Mackevičs ar komandu ieskicēja hipotireozes izpausmes, kas aizkavē pareizas diagnozes noteikšanu, jo nav tik klasiskas, — anēmiju, dislipidēmiju, garastāvokļa svārstības. Šajā numurā skaidrota hipotireozes saistība ar hipogonādismu.
Hipogonādisms vīriešiem
Hipogonādismu vīriešiem raksturo pazemināts testosterona līmenis asinīs, ko attiecīgi pavada hipogonādismam raksturīgi simptomi. Androgēnu deficīta simptomi bieži pārklājas ar hipotireozes simptomātiku, piemēram, sūdzības par nogurumu, palielinātu tauku masu, muskuļu nespēku, seksuālu disfunkciju. Abas šīs patoloģijas sastopamas bieži un kā atsevišķas nozoloģijas ir pietiekami labi izprastas un aprakstītas literatūrā, ietverot to patofizioloģiju, ārstēšanas taktiku un epidemioloģiju. [1]
Pētījumā, kas veikts Bostonā, Masačūsetsā, atklāts, ka simptomātisks hipogonādisms ir 5,6 % vīriešu vecumā no 30 līdz 79 gadiem un sastopamība pieaug līdz ar vecumu. [2]
Kā vairogdziedzera disfunkcija ietekmē androgēnu deficītu?
Primāra hipotireoze asociēta ar sekundāru jeb hipogonadotropu hipogonādismu, kas ir atgriezenisks, sākot vairogdziedzera hormonu substitūcijas terapiju. Lai gan precīzi nav zināms mehānisms, kā hipotireoze izraisa hipogonādismu, ir vairākas teorijas.
Agrāk uzskatīja, ka tas saistāms ar zemu SHBG līmeni, tāpēc ir zems kopējā testosterona līmenis. Novērots, ka vīriešiem ar hipertireozi ir augstāka testosterona un SHBG koncentrācija asinīs. Savukārt, sākot aizstājterapiju, iespējams līdzīgs SHBG un kopējā testosterona līmeņa pacēlums kā hipertireozes gadījumā. Tomēr jāpiemin, ka hipotireozes gadījumā ir zems arī brīvā testosterona līmenis, kas pilnībā neizskaidro zemo testosterona līmeni tikai ar SHBG līmeņa pazeminājumu.
Vēl tika uzskatīts, ka hipogonādisms saistīts ar hiperprolaktinēmiju, jo hipotireozes gadījumā ir pastiprināta tireotropīnu atbrīvojošā hormona (TRH) izdale, kas sekundāri paaugstina prolaktīna līmeni. [3] Hiperprolaktinēmija ietekmē dabisko gonadotropīnus atbrīvojošā hormona (GnRH) pulsveida sekrēciju, kā arī ietekmē hipofīzes atbildreakciju uz GnRH, kas izraisa samazinātu testosterona sekrēciju Leidiga šūnās. [4] Tomēr vīriešiem ar primāru hipotireozi prolaktīna līmenis nepaaugstinās pastāvīgi, izņemot tad, ja attīstījusies smaga ilgstoša primāra hipotireoze. Toties ir novērots, ka prolaktīna līmenis pazeminās, sākot vairogdziedzera substitūcijas terapiju. [5]
Gan hipotireoze, gan hipertireoze var ietekmēt gonādu ass funkciju, un ir dati, kas liecina par iespējamu tiešu T3 ietekmi uz spermatozoīdiem un gonādu šūnām, ietekmējot steroīdģenēzi. T3 receptori ir atrasti gan spermā, nenobriedušās dzimumšūnās, gan Sertoli un Leidiga šūnās. T3 tieši palielina LH receptoru skaitu Leidiga šūnās. Tas stimulē gan bazālo, gan LH inducēto progesterona, testosterona un estradiola sekrēciju Leidiga šūnās. [6] Arī neiropsihiatriskie efekti, kas radušies hipotireozes dēļ, varētu būt saistīti ar seksuālu disfunkciju. Tomēr hipertireozes gadījumā novērota gonadotropīnu hiperreakcija uz GnRH, kas varētu liecināt par vairogdziedzera hormonu lomu gonadotropīnu sensibilizācijas pastiprināšanā. [7]
Interesanti, ka tad, ja vairogdziedzera vēža pacientu terapijā lieto radioaktīvo jodu, novērojami no devas atkarīgi spermatoģenēzes traucējumi, ko pavada FSH pacēlums aptuveni divus gadus. [5]
Pētījumā par 120 vīriešiem ar erektilu disfunkciju hipotireoze atklāta 5 % un hipertireoze 1 % gadījumu. [8] Savukārt pētījumā par 120 pieaugušajiem, kam ir primāra hipotireoze, hipogonādisms bija 67,5 %. Jāpiemin, ka šeit nozīmīgu lomu hipogonādisma attīstībā spēlēja arī tādi faktori kā virssvars un lielāks vecums. [1] Šie dati apstiprina hipotireozes un hipogonādisma asociāciju un augsto sastopamības rādītāju hipotireozes pacientu grupā.
Ko darīt, ja testosterona līmenis ir zems?
Būtiski ņemt vērā — ja tiek konstatēts zems testosterona līmenis, svarīgi ir noteikt LH, FSH līmeni, lai precizētu, vai hipogonādisms ir primārs vai sekundārs. Sekundāra hipogonādisma gadījumā jānosaka prolaktīna līmenis, kā arī pārējie hipofizārie hormoni, uzmanību noteikti pievēršot vairogdziedzera ass funkcijai, jo tas var nozīmīgi mainīt turpmāko ārstēšanas taktiku, tādējādi pacientus pasargājot no nevajadzīgas testosterona aizstājterapijas. [4]
Hipotireoze un hipogonādisms sievietēm
Vairogdziedzera funkcijas traucējumi sievietēm saistāmi ar reproduktīvo disfunkciju: ar menstruālā cikla neregularitāti, neauglību, neveiksmīgu grūtniecības iznākumu un citām ginekoloģiskām slimībām, piemēram, agrīnu olnīcu izsīkumu un policistisko olnīcu sindromu (PCOS). Jāpiemin, ka pat nelielas izmaiņas vairogdziedzera funkcijā pirms grūtniecības un grūtniecības periodā var būtiski ietekmēt iznākumus gan mātei, gan bērnam. [9]
Vairogdziedzera slimības skar gandrīz 14 % sieviešu un ir viena no biežākajām endokrinopātijām reproduktīvā vecuma sievietēm.
Sieviešu dzimums per se ir neatkarīgs riska faktors vairogdziedzera disfunkcijai: sievietēm ir 3—5 × lielāks risks attīstīties autoimūnai vairogdziedzera slimībai nekā vīriešiem. [9]
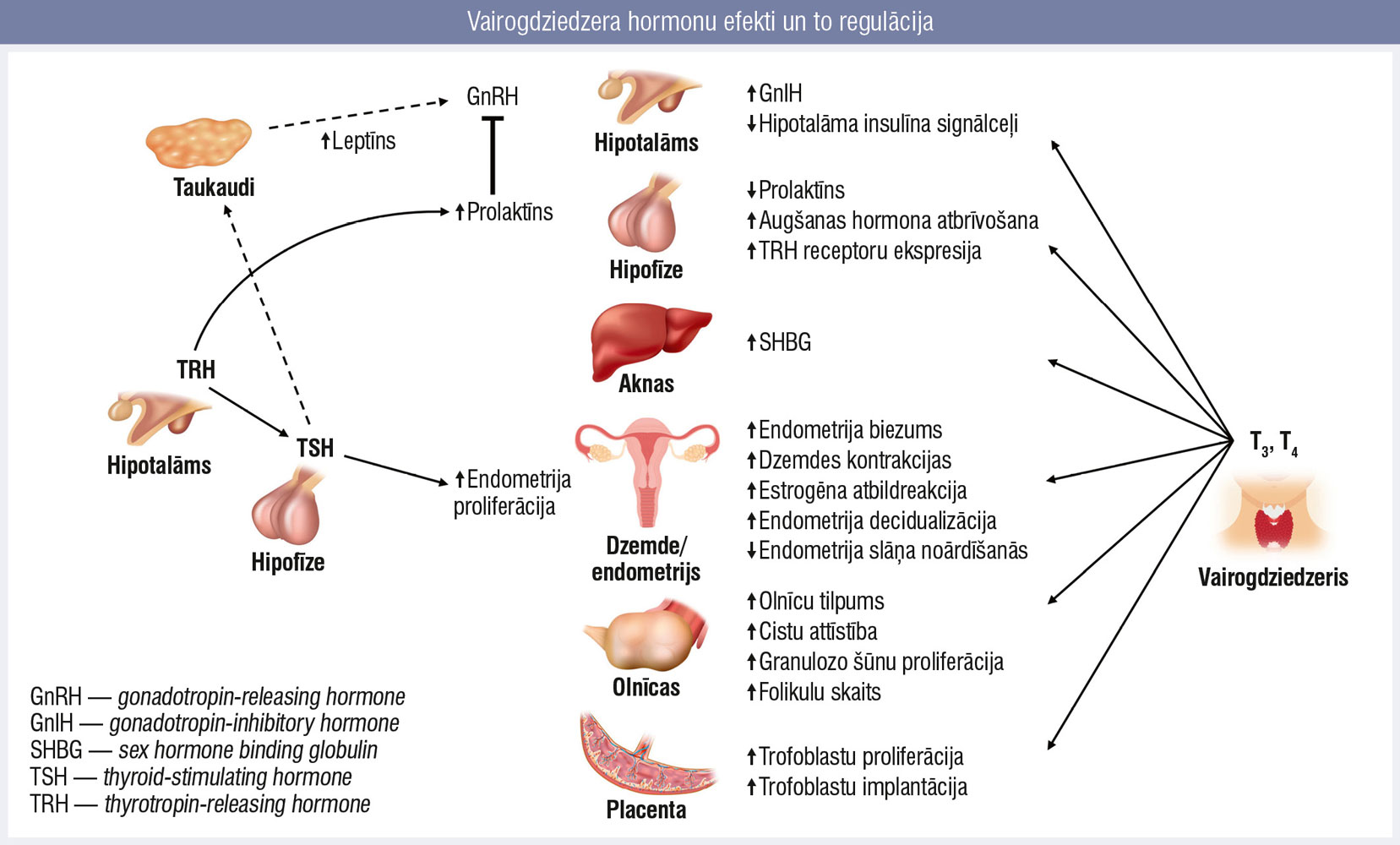

Attēls
Vairogdziedzera hormonu efekti un to regulācija
Vairogdziedzera slimības saistās ar reproduktīvās un metaboliskās funkcijas traucējumiem (attēls). Piemēram, subklīniska hipotireoze asociējas ar PCOS. Savukārt sievietēm ar autoimūnām vairogdziedzera slimībām, piemēram, Hašimoto tireoidītu (HT) vai Greivsa slimību (GS), neauglības biežuma rādītājs sasniedz 50 %, kā arī pastāv lielāks risks priekšlaicīgam olnīcu izsīkumam. [9]
Vairogdziedzera funkcija sievietes reproduktīvo asi ietekmē gan tieši, gan netieši. Hipofīzes—hipotalāma līmenī vairogdziedzera hormoni regulē kispeptīna un GnRH sekrēciju gan tieši, gan netieši — ietekmējot prolaktīnu un leptīnu. Vairogdziedzera hormoni ietekmē arī dzimumhormonu biopieejamību, regulējot saistītājproteīnu līmeni. [9]
Reproduktīvās sistēmas centrālā daļa saņem signālus no:
- enerģijas signālmolekulām, piemēram, glikozes, insulīna, IGF–1 un leptīna,
- ar stresu saistītajām signālmolekulām, piemēram, glikokortikoīdiem un CRH,
- homeostāzes regulatoriem, piemēram, vairogdziedzera hormoniem.
Šos signālus uztver kispeptīna—neirokinīna B dinorfīna neironi, kas ierosina hipotalāma—hipofīzes—gonādu (HPG) ass kaskādi, izdalot kispeptīnu, kas stimulē GnRH izdali no GnRH neironiem. GnRH izraisa LH un FSH izdali no hipofīzes priekšējās daļas, kas iedarbojas uz theca un granulozajām šūnām olnīcās, stimulējot olnīcu steroīdu un peptīdu sintēzi, veicinot folikuloģenēzi. Vairogdziedzera hormoniem — TRH, TSH, T3 un T4 — ir potencējoša loma visos HPG ass līmeņos. Tomēr pastiprināta TRH sekrēcija var netieši ietekmēt GnRH, jo tas ir spēcīgs prolaktīna sekrēcijas stimulators. Prolaktīns inhibē GnRH sekrēciju. Jāpiemin, ka 20 % cilvēku ar subklīnisku hipotireozi ir nozīmīgi paaugstināts arī prolaktīna līmenis, kas, savukārt, nomāc HPG asi. [9]
Vairogdziedzera funkcija un neauglība
TSH ir glikoproteīns, kura alfa apakšvienība ir identiska LH un FSH apakšvienībai. TSH receptori ir atrasti gan folikulārajās, gan Leidiga šūnās. TSH veicina arī endometrija proliferāciju sievietēm ar endometriozi. Vairogdziedzera hormoni pastiprina estrogēnu sintēzi un veicina tā transportu, spēlē tiešu lomu reproduktīvās sistēmas attīstībā un uzturēšanā, ietekmējot olnīcas, dzemdi un endometriju. Koordinēta hormonālā regulācija ir kritiski nepieciešama folikuloģenēzei un gonādu steroīdu produkcijai. Šie efekti ir iespējamie iemesli neauglībai gadījumos, kad attīstās vairogdziedzera disfunkcija. LH un FSH supresija novērota sievietēm ar hipotireozi, kas normalizējas, sasniedzot eitireozi. [1]
Novērota saistība starp vairogdziedzera slimībām un samazinātu olnīcu funkciju. Pētījumā (Hasegawa et al) noskaidrots, ka pacientēm ar autoimūnām vairogdziedzera slimībām ir samazināts anti–Millera hormona (AMH) līmenis, kas tiek izmantots kā kvantitatīvs marķieris olnīcu rezervju izvērtēšanai. [10] Tomēr netika novērota atšķirība starp eitireozes un hipotireozes grupām. Tas varētu būt skaidrojams ar autoimunitāti gan Greivsa slimības, gan Hašimoto tireoidīta gadījumā — abi ir saistīti ar augstākiem neauglības rādītājiem. Tāpat arī anti–TPO antivielas (bet ne TSH) tika saistītas ar mazāku dzīvi dzimušo bērnu skaitu un augstākiem spontāna aborta rādītājiem, kā tas tika novērots pētījumā par 1468 sievietēm ar neauglību. [11] Savukārt pētījumā par sievietēm, kurām nav neauglības, tika novērota negatīva saistība starp anti–TPO antivielu titru un grūtniecības iestāšanos. [12]
Priekšlaicīgs olnīcu izsīkums nozīmē olnīcu funkcijas zudumu līdz 40 gadu vecumam. Tāpat kā samazinātu olnīcu rezervju gadījumā, arī šeit autoimunitāte spēlē nozīmīgu lomu. Kādā pētījumā noteikts, ka tieši vairogdziedzera autoimūnās slimības ir biežākās autoimūnās slimības pacientēm ar priekšlaicīgu olnīcu izsīkumu — pat 35 % gadījumu no kopskaita. [13] PCOS, ko raksturo hiperandrogenēmija, ovulatora disfunkcija, policistiskas olnīcas, ir asociēts ar vairogdziedzera disfunkciju.
Sievietēm ar PCOS ir 3,6 × lielāks risks attīstīties subklīniskai hipotireozei. [14] Tāpat PCOS un hipotireozei ir līdzīgi slimību riski un simptomi, piemēram, oligomenoreja, neauglība, insulīnrezistence un dislipidēmija. [9]
Pētījumi turpinās
Jāsecina, ka vairogdziedzera hormoni būtiski iespaido reproduktīvo sistēmu, vairākos līmeņos ietekmējot hipotalāma—hipofīzes—gonādu asi, tomēr šajā jomā joprojām būtiski trūkst zināšanu. Vairogdziedzera patoloģijas saistās ar tādām reproduktīvās sistēmas slimībām kā agrīns olnīcu izsīkums, PCOS, neauglība, neregulārs menstruālais cikls, menstruālās asiņošanas izmaiņas un nevēlams grūtniecības iznākums.
Pilnībā nav skaidrs, vai nozīmīgāku lomu reproduktīvajā funkcijā spēlē vairogdziedzera funkcionālās izmaiņas vai izmaiņas autoimunitātē, tomēr jādomā, ka nozīmīgas ir abas un ka šajā jomā nepieciešami turpmāki pētījumi.