Disbakterioze. Bieži sastopama, bet vai atpazīta?
Tievo zarnu proliferācijas sindroms — disbakteriozes iemesls
Tievo zarnu proliferācijas sindroms (small intestinal bacterial overgrowth jeb SIBO) pirmoreiz pieminēts 1897. gadā klīniskajā gadījumā par “aklās cilpas sindromu”. Šobrīd SIBO tiek raksturots kā bieža, taču nereti nediagnosticēta gastrointestināla slimība. Tās pamatā ir palielināts baktēriju skaits tievajās zarnās, kas rada disbiozi. Šīs baktērijas ir parasti resnajā zarnā atrodamās Grama negatīvās baktērijas, kuras fermentē ogļhidrātus. Turklāt SIBO nereti saista ar citām slimībām, visbiežāk — kairināto zarnu sindromu. [1; 2; 15]
SIBO diagnostiku apgrūtina tas, ka slimībai ir nespecifiski simptomi: meteorisms, sāpes vēderā, caureja vai aizcietējumi, taču raksturīgs arī uzturvielu deficīts. [3] “Zelta standarts” SIBO diagnostikā ir baktēriju skaita noteikšana tievās zarnas aspirātā, kas iegūts augšējās endoskopijas laikā un pēc tam tiek kultivēts, taču procedūra ir laikietilpīga, invazīva, salīdzinoši dārga, bet materiāla kontaminācijas dēļ iespējami viltus pozitīvi rezultāti, tāpēc šobrīd diagnostikai izmanto izelpas testus. [15]
SIBO ārstēšanas pamatā ir diēta un dzīvesveida izmaiņas, kā arī antibakteriālā terapija, probiotikas. [4]
Etioloģija, riska faktori un patoģenēze
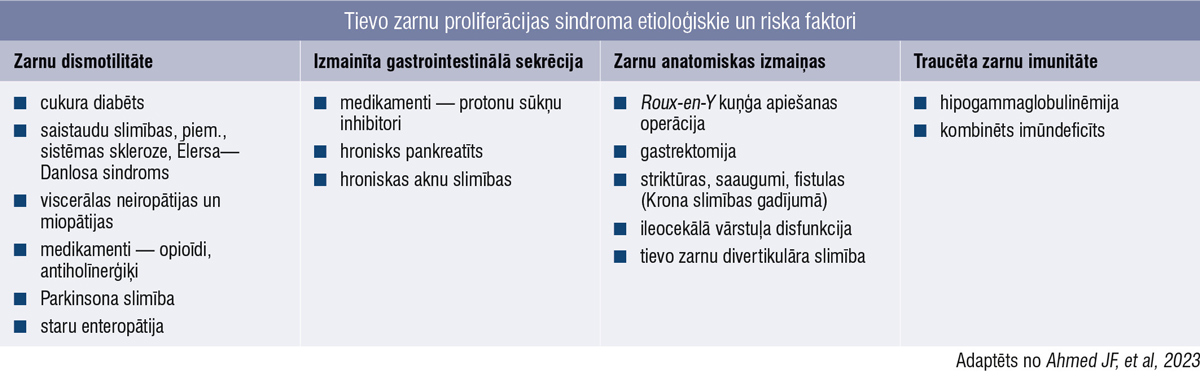
Tievajā zarnā, salīdzinot ar resno zarnu, mīt maz baktēriju, ko nodrošina dažādi endogēnie aizsargmehānismi — kuņģa skābe, aizkuņģa dziedzera un žultspūšļa izdalītie sekrēti, zarnu lokālā imūnā sistēma, tievo zarnu motilitāte, kā arī ileocekālais vārstulis. SIBO etioloģija galvenokārt tiek saistīta ar zarnu dismotilitāti, izmainītu gastrointestinālo sekrēciju, zarnu anatomiskām izmaiņām un traucētu zarnu imunitāti (1. tabula). Dažādi etioloģiskie faktori nereti mijiedarbojas. [4; 5]

Tievajā zarnā notiek antegrāda peristaltika, kas nodrošina zarnu satura kustību un novērš stāzi, tādā veidā ierobežojot baktēriju proliferāciju tievajā zarnā. Kā būtiskus piemērus dismotilitātes izraisītam SIBO var minēt diabētisku autonomu neiropātiju un sistēmas sklerozi. [6]
2021. gadā veiktā meta–analīzē iegūtie dati uzrādīja, ka 29 % no pētījumā iekļautajiem cukura diabēta pacientiem tika atklāts SIBO, turklāt SIBO risks pacientiem ar cukura diabētu ir gandrīz trīs reizes lielāks nekā cilvēkiem, kuri neslimo ar cukura diabētu. [7]
Savukārt Parkinsona slimības gadījumā SIBO tiek diagnosticēts pat pusei pacientu. [8]
Baktēriju proliferāciju tievajā zarnā ierobežo arī parietālo šūnu izdalītā sālsskābe. Kuņģa skābā vide iznīcina līdz 99 % baktēriju kuņģī un divpadsmitpirkstu zarnas proksimālajā daļā. [4] Medikamentu lietošana, kas pazemina kuņģa skābes līmeni, izraisot hipohlorīdiju, piemēram, ilgstoša protonu sūkņu inhibitoru lietošana, tiek saistīta ar SIBO attīstību. [9; 10]
Aizkuņģa dziedzeris izdala tādus enzīmus kā lipāze un proteāze, kas nodrošina to, ka nenotiek pārmērīga baktēriju proliferācija tievajā zarnā, jo šiem enzīmiem ir antibakteriālas īpašības, tie netieši stimulē antegrādu zarnu peristaltiku. [4]
Hroniska pankreatīta gadījumā līdz 40,8 % pacientu ir SIBO, ko saista ne tikai ar aizkuņģa dziedzera eksokrīnu nepietiekamību, bet arī opioīdu lietošanu hroniska pankreatīta sāpju mazināšanai. Turklāt aizkuņģa dziedzera un zarnu trakta operācijas anamnēzē hroniska pankreatīta pacientiem arī ir predisponējošs faktors SIBO attīstībai. [11; 12]
Virkne ķirurģisku procedūru, kad tiek izmainīta zarnu anatomija, tiek saistītas ar SIBO attīstības risku, piemēram, gastrektomija un Roux-en-Y kuņģa apiešanas procedūra. Kā patofizioloģiskus faktorus SIBO attīstībai pēc ķirurģiskām procedūrām definē hipohlorīdiju, izmaiņas gremošanas fermentos un to sekrēcijā, izmaiņas zarnu motilitātē un atsevišķos gadījumos arī aklas zarnu cilpas veidošanos, kur notiek stāze, tādējādi pastiprināti proliferējot baktērijām. [6]
Ileocekālā vārstuļa bojājums, kas var būt kā ķirurģisks, tā, piemēram, Krona slimības izraisīts, izsauc resnās zarnas baktēriju translokāciju tievajā zarnā. [13] SIBO ir piektdaļai iekaisīgu zarnu slimību pacientu, bet Krona slimības pacientiem, kam veikta ileocekālā vārstuļa operācija, SIBO ir pat 33 % gadījumu. [14]
Gastrointestinālā trakta aizsargmehānisma lomu pilda arī lokālā imūnā sistēma. Tā, piemēram, Paneta šūnas, kas atrodas tievo zarnu kriptās, sekretē antibakteriālus peptīdus jeb defensīnus, kas nodrošina gļotādas barjerfunkciju. IgA antivielas ir būtiskas, lai tievajā zarnā būtu maz baktēriju, jo bloķē to piesaisti un proliferāciju. Tādējādi imūnā sistēma regulē zarnu mikrobiotas sastāvu un traucējumi imūnsistēmas darbībā, piemēram, kombinētais imūndeficīts, IgA deficīts, hipogammaglobulinēmija, ir būtiski riska faktori SIBO attīstībā. [4; 15]
Klīnika
Klīniski SIBO var būt asimptomātisks vai imitēt kairinātu zarnu sindromu, ko raksturo tādi simptomi kā meteorisms, gāzu uzkrāšanās, sāpes/diskomforts vēderā, diareja vai aizcietējumi. Šos simptomus pieredz 60 % SIBO pacientu. Smagākos gadījumos var būt malabsorbcijas pazīmes (svara zudums, steatoreja, malnutrīcija), aknu bojājums, izpausmes uz ādas (rozācija, akne), artralģija, uzturvielu deficīts — D vitamīna, B12 vitamīna, dzelzs deficīts. [3; 5]
Patofizioloģiski SIBO simptomu un klīnisko izpausmju attīstības pamatā ir trīs mehānismi: gļotādas bojājums, ko izraisa baktērijas un/vai to izdalītie toksīni, konkurence ar saimniekorganismu par uzturvielām un baktēriju metabolisma ietekme (2. tabula). [6]


SIBO diagnostika
Tievās zarnas aspirāts
Par SIBO diagnostikas “zelta standartu” tiek uzskatīts tievās zarnas aspirāts augšējās endoskopijas laikā, visbiežāk no jejunum.
Tievās zarnas aspirāta baktēriju koncentrācija > 103 koloniju veidojošo vienību (CFU)/ml ir SIBO diagnostiskais kritērijs. Visbiežāk identificētās baktēriju kultūras ir Bacteroides, Enterococcus un Lactobacillus. [2]
Taču šai metodei ir daudz trūkumu, tā ir invazīva procedūra, jo jejunālo aspirātu iegūst augšējās endoskopijas laikā caur sterilu katetru. Iegūtais aspirāts nekavējoties jāievieto anaerobā flakonā un saturs jākultivē aerobo un anaerobo mikroorganismu augšanai. Viltus pozitīvs rezultāts var rasties, ja paraugņemšanas laikā tas tiek inficēts ar orofaringeālo floru.
Ūdeņraža (H2) elptesti
Tievās zarnas aspirāta kultivēšanas metodes ierobežojumu dēļ SIBO diagnostikai praksē visbiežāk tiek izmantoti ūdeņraža (H2) elptesti — glikozes un laktulozes elptesti. Ūdeņraža elptesti tiek rekomendēti kā pirmās rindas izmeklējumi SIBO diagnostikai, jo tie ir neinvazīvi, ērti, vienkārši un samērā viegli veicami.
Ūdeņraža elptesti darbojas pēc principa, ka izmantojamais substrāts (parasti ogļhidrāti) gremošanas sistēmas mikroorganismu metabolizācijas rezultātā (cilvēka šūnas nespēj ražot ūdeņraža un metāna gāzes) izraisīs ūdeņraža vai metāna ražošanu, kas tiek absorbēts, vēlāk izdalīts izelpas laikā un reģistrēts. Visbiežāk SIBO elptestu veikšanai tiek izmantota glikoze vai laktuloze. [4]
Laktulozes (SIBO/tranzīts) elptests. Cilvēka organisms nespēj metabolizēt laktulozi, kas ir disaharīds, tāpēc laktuloze iziet cauri visām tievo zarnu daļām. 90—120 minūtes pēc laktulozes ieņemšanas tā nesašķeltā veidā nonāk resnajā zarnā (kas arī atspoguļo normālu orocekālā tranzīta laiku), kur to metabolizē zarnu mikroorganismi.
Metabolizācijas procesā radušās gāzes — ūdeņradis un metāns (H2, CH4) uzsūcas caur portālo vēnu sistēmu un aknām un izdalās caur plaušām. Reģistrējot ūdeņraža un metāna (H2, CH4) koncentrācijas pieaugumu virs normas, tiek diagnosticēts SIBO. Jāņem vērā, ka laktulozes elptesta rezultātus var ietekmēt zarnu motilitāte, īpaši pacientiem ar caurejām, kas ierobežo šā testa lietošanu.
Glikozes elptests. Glikoze ātri absorbējas tievo zarnu proksimālajā daļā un visbiežāk nesasniedz tievo zarnu distālās daļas, tāpēc glikozes tests nav tik precīzs zarnu distālās daļas SIBO diagnostikai kā laktulozes elptests.
Glikozes elptestam visbiežāk nozīmē 50—75 g glikozes, un elptests tiek veikts pēc 2—3 stundām. Glikozes tests tiek uzskatīts par pozitīvu, ja pamata (H2, CH4) ekskrēcija > 20 ppm (parts per million) un/vai kāpums pēc glikozes ieņemšanas > 12—15 ppm.
SIBO elptestiem ir zemāka jutība (glikozes elptestam 44 %, laktulozes elptestam 31 %), bet lielāks specifiskums (glikozes elptestam 80 %, laktulozes elptestam 86 %), salīdzinot ar tievās zarnas aspirātu. [16]
Lai arī elptestus plaši lieto SIBO diagnostikai, tiem ir arī trūkumi: laktulozes elptests tiek kritizēts sakarā ar augstām viltus pozitīvām vērtībām (paātrināta zarnu tranzīta dēļ), bet glikozes elptestam ir zema jutība, lai noteiktu distālo SIBO, jo substrāts uzsūcas tievās zarnas proksimālajā daļā.
Kapsulu tehnoloģijas SIBO diagnostikai
SIBO diagnostikā tiek izstrādātas kapsulu tehnoloģijas, ar ko varēs veikt SIBO mērījumus reāllaikā. Kapsulu sensori, pārvietojoties gremošanas sistēmas traktā, reģistrē gremošanas sistēmas intraluminālās gāzes — ūdeņradi, oglekļa dioksīdu un metānu. Tādējādi var iegūt drošus un kvalitatīvus reāllaika datus SIBO diagnostikai. [17]
SIBO korekcijas iespējas
Uzturs un dzīvesveids
SIBO terapijas galvenais pamatprincips ir identificēt un koriģēt etioloģiskos un veicinošos faktorus, mainot ēdienkarti, dzīvesveidu un/vai izmantojot medikamentozas vai ķirurģiskas ārstnieciskās metodes.
Tiek rekomendēts mazināt ogļhidrātu daudzumu uzturā, izvairīties no NSPL lietošanas, svarīgi ir atmest smēķēšanu. Fermentējamie oligosaharīdi, disaharīdi un monosaharīdi, un polioli (FODMAP) ir īsas ķēdes ogļhidrāti, kas slikti uzsūcas un ir osmotiski aktīvi zarnu lūmenā, kur tos ātri fermentē tievo zarnu baktērijas. Diēta, kurā ir zems FODMAP saturs, mazina vēdera uzpūšanos (meteorismu) un gāzu veidošanos pacientiem ar kairinātu zarnu sindromu, tāpēc tā var palīdzēt arī simptomātiskiem SIBO pacientiem, taču ļoti svarīga ir dietologa uzraudzība. [18]
Antibiotikas
SIBO terapijas pamatā ir antibiotiku lietošana, lai samazinātu, nevis pilnībā izskaustu tievo zarnu baktēriju slogu un novērstu gļotādas iekaisumu, kas saistīts ar pārmērīgu augšanu un malabsorbciju.
Kopumā antibiotikas normalizē SIBO procesus 51,1 % pacientu ar izmainītu elptestu, un šis ir ievērojami augstāks rādītājs nekā placebo (9,8 %). [19] Antibiotiku izvēli nosaka vietējie antibiotiku rezistences rādītāji, izmaksas, pacientu alerģiskās reakcijas, kā arī zāļu rezistences riska faktori.
Visspēcīgākā pierādījumu bāze SIBO ārstēšanai ir rifaksimīnam 550 mg 2 × dienā 7—14 dienas. Antibiotikas, kurām arī ir pierādīta efektivitāte SIBO terapijā, ir ciprofloksacīns 500 mg 2 × dienā, metronidazols 250 mg 3 × dienā, norfloksacīns 400 mg 4 × dienā un trimetoprims/sulfametoksazols 160/800 mg 2 × dienā. [20]
Atkārtots antibiotiku terapijas kurss SIBO pacientiem tiek piedāvāts tad, ja ir daļēja simptomu mazināšanās vai agrīns recidīvs (pēc < 3 mēnešiem), bet šādos gadījumos tiek nozīmēta terapija ar citu antibiotiku.
Pierādīts, ka recidīvs pēc viena antibiotiku kursa biežāk ir gados vecākiem pacientiem, kuriem anamnēzē ir apendektomija, un tiem, kuriem anamnēzē ir ilgstoša protonu sūkņu inhibitoru lietošana neskaidru iemeslu dēļ. [21] Pacientiem, kuriem simptomu izpausmes nemazinās pēc diviem antibiotiku kursiem vai simptomi progresē, jāizvērtē alternatīvas diagnozes, piemēram, celiakija vai kairinātu zarnu sindroms.
Probiotikas
Vairākos pētījumos analizēta probiotiku ietekme uz SIBO, taču šajos pētījumos trūkst konsekvences izmantotajās zāļu formās, ārstēšanas ilgumā, analizētajās pacientu grupās un diagnostikas
metodēs.
Meta–analīzē apkopoti pētījumi par probiotiku lietošanu SIBO terapijā un konstatēts, ka probiotikas, šķiet, samazina ūdeņraža ražošanu ar izredžu attiecību 1,61 (TI 1,19—2,17), bet iekļautie pētījumi pārsvarā bijuši nelieli un nekvalitatīvi. [22] Lai izprastu probiotiku ietekmi uz SIBO risku un lomu terapijā, nepieciešami lielapjoma kvalitatīvi pētījumi. Šobrīd trūkst pietiekamas pierādījumu bāzes un datu, lai ieteiktu konkrētu probiotiku lietošanu SIBO ārstēšanā. [2]
Disbakterioze — arī ginekoloģijā
Komentē Dr. Natālija Bērza
Normāla sievietes dzimumceļu mikrobiota
Maksts mikrobiota ir sarežģīta un dinamiska mikroekosistēma, kas sievietes dzīves laikā pastāvīgi mainās un ir atkarīga no sievietes menstruālā cikla un dzīves posma. Veselā maksts mikrobiotā dominē Lactobacillus ģints pārstāvji, kas ražo dažādus antibakteriālus savienojumus. Taču makstī mazākumā pārstāvēti arī stafilokoki (Staphylococcus aureus — retāk, biežāk koagulāzes negatīvi stafilokoki), streptokoki (arī B grupas), enterokoki, gardnerellas, mikoplazmas, ureaplazmas, enterobaktērijas. Šajā trauslajā ekosistēmā starp mikrobiotu un saimniekorganismu pastāv homeostatiskas savstarpējās attiecības. Sievietes organisms mikroorganismiem nodrošina mitru, barojošu un siltu vidi, savukārt mikroorganismi rada vidi pret patogēnajiem mikroorganismiem un ražo pretiekaisuma faktorus. Tādējādi tiek izveidota pirmā aizsardzības līnija pret patogēnajiem mikroorganismiem, kas var ierosināt infekcijas.
Maksts mikroflorā dominē pienskābās baktērijas jeb Lactobacillus ģints (tās ir Gr(+) nūjiņas), tiek izdalītas daudzas sugas, kas sastopamas normālā maksts mikroflorā: L. plantarum, L. acidophilus, L. jensenii, L. casei, L. fermentum, L. rhamnosus, L. reuteri, L. iners, L. crispatus u.c. Modernās un uzlabotās molekulārās noteikšanas metodes, izmantojot 16S rRNS gēnu sekvencēšanu, ļāvušas grupēt maksts baktēriju mikrobiotu īpašos kopienas tipos (CST), tāpēc šobrīd par atsevišķām sugām tiek runāts maz.
Maksts mikrobiotas uzbūvi iedala piecos veidos, ko medicīnas literatūrā sauc arī par klasteriem (kopas — CST). CST I, II, III un V dominē attiecīgi Lactobacillus crispatus, Lactobacillus gasseri, Lactobacillus iners un Lactobacillus jensenii. CST IV ietver lielāku strikti anaerobo baktēriju kopu, piemēram, Prevotella, Dialister, Atopobium, Gardnerella, Megasphaera, Peptoniphilus, Sneathia, Eggerthella, Aerococcus, Finegoldia un Mobiluncus ģinšu sugu daudzumu, un to raksturo lielāka daudzveidība un vienmērīgums. CST IV var iedalīt apakšgrupās: CST IVA, kas satur L. iners un stingrus anaerobus, un CST IVB, kas satur ar bakteriālu vaginozi (BV) saistītās baktēriju sugas (BVAB) (baktērijas Clostridiales secībā). CST IVC raksturo daudzveidīgu fakultatīvu un strikti anaerobu baktēriju klāsts, ko var iedalīt piecās apakškategorijās. Kopumā ar veselīgu maksts mikrofloru visbiežāk saistītas CST I, II un V, bet CST IV pārsvars var klīniski izpausties kā BV vai aerobs vaginīts. Interesanti, ka CST III saistīta gan ar veselīgu maksts mikrofloru, gan ar disbiozi un bieži ar BV.
Maksts ekosistēmu ietekmējošie faktori
Maksts ekosistēma jeb mikroflora ir dinamiska vide, kas atkarīga no daudziem faktoriem: vecuma, hormonālajām svārstībām (sievietes menstruālā cikla), imunitātes, veselības stāvokļa un lietotajiem medikamentiem. Viens no svarīgākajiem ietekmējošajiem faktoriem ir vecums.
Kamēr jaundzimušās meitenes šķērso dzemdību ceļus, Lactobacillus ģints baktērijas kolonizē tās un dominē makstī aptuveni sešas nedēļas, kamēr ir estrogēnu piesātinājums, kas saņemts no mātes organisma (estrogēns ir svarīgs faktors, kas pienskābajām baktērijām palīdz piesaistīties pie maksts gļotādas). Pēc tam estrogēna līmenis meiteņu asinīs krītas, vaginālās floras sastāvs mainās uz stafilokokiem, streptokokiem un enterobaktērijām līdz pubertātei. Pubertāte inducē estrogēnu produkciju, un vaginālā flora atkal mainās. Lactobacillus atjaunojas kā dominējošais floras pārstāvis. Menopauzē estrogēnu trūkuma dēļ maksts mikroflorā atgriežas koki un zarnu floras pārstāvji, bet pienskābās baktērijas samazinās.
Dibakteriozes simptomātika
Disbakterioze sievietes dzimumceļos izpaužas kā iekaisums, ko mēdz saukt arī par kolpītu. Kolpīts ir vispārējs termins maksts slimību grupai, ko izraisa infekcija, iekaisums vai normālas maksts mikrofloras izmaiņas. Biežākie simptomi ir izdalījumi no dzimumceļiem, smaka, nieze un/vai diskomforts. Maksts infekcijas ir viens no biežākajiem iemesliem, kāpēc sievietes meklē ginekologa palīdzību. Visbiežākās maksts infekcijas ir bakteriālā vaginoze, Candida vulvovaginīts, trihomoniāze, ka arī aerobais vaginīts. Pasaulē tiek veikti daudzi pētījumi par maksts infekcijām grūtniecēm, īpaši bakterialo vaginozi un aerobo vaginītu, jo tās var būt iemesls tādiem sarežģījumiem kā priekšlaicīgas dzemdības, horionamnionīts un mazs dzimšanas svars, ar to bieži saistīts CST IV tips. Maksts infekcijas palielina risku dzimumakta laikā saslimt ar HIV/AIDS, HPV un citām STS.
Ārstēšanas iespējas
Nav universālu līdzekļu maksts disbakteriozes novēršanai. Maksts sēnīšinfekcijas terapijā bieži tiek lietoti lokālie azolu grupas preparāti, bet komplicētu maksts sēnīšinfekciju ārstēšanā priekšroka tiek dota sistēmiskiem azolu grupas preparātiem. Bakteriālās vaginozes gadījumā tiek lietota antibakteriālā terapija ar klindamicīnu vai metronidazolu. Ir arī jaunas medikamentu grupas cīņā pret disbakteriozi — antiseptiķi. Pie profilaktiskiem līdzekļiem pieder probiotiku grupas preparāti. Visi šie līdzekļi veido uzticamu kombināciju maksts infekciju terapijā.
Mutes dobums un mikrobioms
Komentē Doc. Ilze Maldupa
Mikrobioma loma mutes dobuma veselībā
Cilvēka organisms nevar pastāvēt bez mikroorganismiem. Vienlīdz liela nozīme ir cilvēka šūnu ģenētiskajam materiālam un uz mums mītošo mikrobu gēniem. Ir tādas vispārējai veselībai svarīgas funkcijas, ko veic mutes mikroorganismi un ko mūsu organisms nespēj veikt, piemēram, nitrītu sintēze no uztura nitrātiem. [37] Tieši tāpēc mūsu organismā paredzēts izstrādāt vielas, radot vidi, kas piesaista noteiktas mums vajadzīgās baktērijas; zinām, ka iedzimst spēja piesaistīt ar veselību saistāmās baktērijas, bet vide var apstākļus izmainīt, līdz pārsvaru ņem nevēlamās baktērijas, kas aktivē kariesu [26] un periodonta slimības. [31]
Iespējams, pats būtiskākais disbakteriozes izraisītājs ir cukurs, kura lomu kariesa attīstībā pierādīja klīniskā pētījumā jau pagājušā gadsimta vidū, [27] bet tā nozīmi kariesa patoģenēzē pilnībā aprakstīja tikai gadsimta beigās [34] — vienkāršos cukurus savā metabolismā izmanto arī labās mikrobioma baktērijas, bet kā blakusprodukts veidojas skābes, kas pamazām maina aplikuma ekoloģiju; vairojas arvien vairāk acidofilo un acidogēno baktēriju, līdz vide izmainījusies tā, ka nozīmīga daļa no labajām baktērijām vairs nespēj pastāvēt, mikrofloras daudzveidība mazinās, vide kļūst arvien skābāka, tālāk izraisot minerālvielu zudumu zobu emaljā un kariesa sākumu.
Periodonta slimību etioloģijā aplikums ir būtisks faktors, jo, aplikumam kļūstot biezākam, tā dziļākajos slāņos vide kļūst anaeroba, tāpēc palielinās šādu vidi mīlošu baktēriju sugu daudzums, [30] bet vēl būtiskāka par mikroorganismu sastāvu iekaisuma izraisīšanā ir tieši saimniekorganisma imūnā atbildreakcija. [28] Iespējams, saimnieka imūnsistēmas īpatnību dēļ iekaisuma reakcija ir spēcīgāka vai arī kāda anaerobā baktērija izsauc īpaši spēcīgu atbildreakciju, kas, savukārt, izmaina smaganu šķidruma kompozīciju un tur prevalējošās vielas maina mutes mikrobiomu. [33] Zinām, ka izšķirīgs periodonta slimību izraisīšanā ir uzturs: ja netiek uzņemti vienkāršie cukuri, tad iekaisuma reakcija smaganās nerodas pat tad, ja aplikuma daudzums palielinās. [25] Ir arī pētīts mehānisms šādai cukura saistībai ar iekaisuma veicināšanu un mikrobioma pārmaiņām aplikumā. [31]
Trešais iespējamais negatīvais efekts ir kandidoze, kas arī biežāk rodas imūnsistēmas traucējumu dēļ un izpaužas tāpēc, ka mutes dobumā ir disbioze. [36]
Izolēta disbakterioze mutes dobumā — vai var tā būt?
Mūsu organisma un mikrobu mijiedarbībā vēl ir pietiekami daudz nezināmā, kas tiek pētīts, un jaunas zināšanas vēl radīsies. Mūsu paradumi atšķirīgi ietekmē mutes un zarnu mikrobiomu, iespaidojot gan ekspozīcijas laiku, gan organisma atbildreakciju. Kaut smēķēšana izraisa izmaiņas arī zarnu vidē, mūsu organisms cenšas mazināt negatīvo ietekmi uz zarnu mikrobiomu, [32] bet mutes mikrobioma izmaiņas smēķēšanas ietekmē ir pastāvīgas. [35] Pēc antibiotiku kursa mutes mikroflora atgriežas normā dažos mēnešos, bet izmaiņas zarnās novēro pat gadu pēc antibiotiku lietošanas. [38] Iekaisuma reakcija var izsaukt konkrētu patogēnu skaita savairošanos mutes mikrobiomā imūnsistēmas aktivitāšu dēļ izmainītā smaganu rievas šķidrumā, bet šīs izmaiņas var būt atšķirīgas zarnās. Izolēti mutes mikrobiomu var ietekmēt arī ar zobu pastu [23] — izmantojot enzīmu kompleksu, zinātniekiem izdevās palielināt ar veselību saistīto baktēriju daudzumu.
Tomēr biežākais disbakteriozes iemesls, kas saistāms ar slimību attīstību mūsdienu sabiedrībā, ir saharoze un citi rafinētie ogļhidrāti.
Eksperimentā, kad cilvēkiem četras nedēļas lika dzīvot kā akmens laikmetā un nebija pieejas higiēnai, mutē palielinājās aplikuma daudzums, baktēriju skaits, bet samazinājās smaganu asiņošana un citi iekaisuma rādītāji — mutes audi bija veselīgāki bez higiēnas, bet ar uzturu, kurā nav rūpnieciski pārstrādātu produktu. [25] Un cukura lietošana uzturā atstāj iespaidu arī uz zarnu mikrobiomu. Īpaši svarīgi tas ir maziem bērniem. Izšķirīgi ir pirmie 2—3 gadi, kad mikrobioms veidojas un nostabilizējas. Šajā periodā mikrobioma sastāvu ietekmē gan dzemdību veids, [24] gan zīdīšana vai mākslīgā maisījuma lietošana, [29] gan piebarojuma sākšana, kam ir nozīme arī zarnu mikrobioma sastāvā pieaugušā vecumā.
Disbakteriozes noteikšana mutes dobumā
Specializētās laboratorijās šāda kapacitāte, protams, ir, bet tikai pētniecības nolūkos. Ticamas komerciālas metodes, kas varētu noteikt, cik veselīgs ir mikrobioms, mums nav. Tomēr ir klīniskās pazīmes — kariesa veidošanās, emaljas demineralizācija notiek tikai disbakteriozes apstākļos, skābā vidē; tātad, ja redzam aktīvus kariozus bojājumus, tas ir simptoms, ka disbakterioze, visticamāk, skārusi ne tikai mutes dobumu, bet arī zarnu traktu.
Profilakses pasākumu nozīme
Svarīgi veicināt dabiskas dzemdības, zīdīšanu (tikai ar krūti līdz sešu mēnešu vecumam, turpināt līdz vismaz divu gadu vecumam paralēli citiem ēdieniem), piebarojumu sākt ar neapstrādātiem vai minimāli pārstrādātiem dārzeņiem un augļiem, izvairīties no pārstrādātiem un ultra pārstrādātiem produktiem, no “specializētās bērnu pārtikas” — bērniem/zīdaiņiem domātām putrām, biezeņiem, smūtijiem, tējām u.tml. rūpnieciski ražotiem produktiem. Un tāpat arī visas dzīves laikā — pamatā pārtikt no neapstrādātiem vai minimāli apstrādātiem produktiem, nelietot rūpnieciski ražotu pārtiku, nelietot antibakteriālus mutes kopšanas līdzekļus.
Literatūra
- Achufusi TGO, et al. (2020). Small Intestinal Bacterial Overgrowth: Comprehensive Review of Diagnosis, Prevention, and Treatment Methods. Cureus, 12(6), e8860.
- Pimentel M, et al. (2020). ACG Clinical Guideline: Small Intestinal Bacterial Overgrowth. The American journal of gastroenterology, 115(2), 165–178.
- Maliszewska P. (2021). Small Intestinal Bacterial Overgrowth: Diagnosis, Pathophysiology and Treatment Methods. Journal of Health Study and Medicine, 2021(1), 101–116.
- Ahmed JF, et al. (2022). Aetiology, diagnosis and management of small intestinal bacterial overgrowth. Frontline gastroenterology, 14(2), 149–154.
- Bures J, et al. (2010). Small intestinal bacterial overgrowth syndrome. World journal of gastroenterology, 16(24), 2978–2990.
- Bushyhead D, Quigley EMM. (2022). Small Intestinal Bacterial Overgrowth–Pathophysiology and Its Implications for Definition and Management. Gastroenterology, 163(3), 593–607.
- Feng X, Li XQ. (2022). The prevalence of small intestinal bacterial overgrowth in diabetes mellitus: a systematic review and meta–analysis. Aging, 14(2), 975–988.
- Li X, et al. (2021). Association of small intestinal bacterial overgrowth with Parkinson’s disease: a systematic review and meta–analysis. Gut pathogens, 13(1), 25.
- Su T, et al. (2018). Meta–analysis: proton pump inhibitors moderately increase the risk of small intestinal bacterial overgrowth. Journal of gastroenterology, 53(1), 27–36.
- Bastiani R, et al. (2023). Assessment of small intestinal bacterial overgrowth and methane production in patients on chronic proton–pump inhibitor treatment: prevalence and role of rifaximin in its management in primary care. Minerva gastroenterology, 10.
- Ní Chonchubhair HM, et al. (2018). The prevalence of small intestinal bacterial overgrowth in non–surgical patients with chronic pancreatitis and pancreatic exocrine insufficiency (PEI). Pancreatology: official journal of the International Association of Pancreatology (IAP), 18(4), 379–385.
- Lee AA, et al. (2019). Small Intestinal Bacterial Overgrowth Is Common in Chronic Pancreatitis and Associates With Diabetes, Chronic Pancreatitis Severity, Low Zinc Levels, and Opiate Use. American journal of gastroenterology, 114(7), 1163–1171.
- Bohm M, et al. (2013). Diagnosis and management of small intestinal bacterial overgrowth. Nutrition in clinical practice: official publication of the American Society for Parenteral and Enteral Nutrition, 28(3), 289–299.
- Shah A, et al. (2019). Systematic review with meta–analysis: the prevalence of small intestinal bacterial overgrowth in inflammatory bowel disease. Alimentary pharmacology & therapeutics, 49(6), 624–635.
- Skrzydło–Radomańska B, Cukrowska B. (2022). How to Recognize and Treat Small Intestinal Bacterial Overgrowth? Journal of clinical medicine, 11(20), 6017.
- Gibson GR, et al. (1990). Alternative pathways for hydrogen disposal during fermentation in the human colon. Gut, 31(6), 679–683.
- Kalantar–Zadeh K, et al. (2018). A human pilot trial of ingestible electronic capsules capable of sensing different gases in the gut. Nature Electronics, 1(1), 79–87.
- Vasant DH, et al. (2021). British Society of Gastroenterology guidelines on the management of irritable bowel syndrome. Gut, 70(7), 1214–1240.
- Shah SC, et al. (2013). Meta–analysis: antibiotic therapy for small intestinal bacterial overgrowth. Alimentary pharmacology & therapeutics, 38(8), 925–934.
- Quigley EMM, et al. (2020). AGA Clinical Practice Update on Small Intestinal Bacterial Overgrowth: Expert Review. Gastroenterology, 159(4), 1526–1532.
- Lauritano E, et al (2008). Small Intestinal Bacterial Overgrowth Recurrence After Antibiotic Therapy. The American journal of gastroenterology, 103: 2031–2035.
- Zhong C, et al. (2017). Probiotics for Preventing and Treating Small Intestinal Bacterial Overgrowth: A Meta–Analysis and Systematic Review of Current Evidence. Journal of clinical gastroenterology, 51(4), 300–311.
- Adams SE, et al. (2017). A randomised clinical study to determine the effect of a toothpaste containing enzymes and proteins on plaque oral microbiome ecology. Scientific reports, 7, 43344.
- Bäckhed F, et al. (2015). Dynamics and Stabilization of the Human Gut Microbiome during the First Year of Life. Cell host & microbe, 17(5), 690–703.
- Baumgartner S, et al. (2009). The impact of the stone age diet on gingival conditions in the absence of oral hygiene. Journal of periodontology, 80(5), 759–768.
- Gomez A, et al. (2017). Host Genetic Control of the Oral Microbiome in Health and Disease. Cell host & microbe, 22(3), 269–278.e3.
- Gustafsson BE, et al. (1954). The Vipeholm dental caries study; the effect of different levels of carbohydrate intake on caries activity in 436 individuals observed for five years. Acta odontologica Scandinavica, 11(3–4), 232–264.
- Hernández M, et al. (2011). Host–Pathogen Interactions in Progressive Chronic Periodontitis. Journal of dental research, 90(10), 1164–1170.
- Holgerson PL, et al. (2013). Oral microbial profile discriminates breast–fed from formula–fed infants. Journal of pediatric gastroenterology and nutrition, 56(2), 127–136.
- Kinane DF, et al. (2017). Periodontal diseases. Nature reviews. Disease primers, 3, 17038.
- Lafleur S, et al. (2023). Multi–Omics Data Integration Reveals Key Variables Contributing to Subgingival Microbiome Dysbiosis–Induced Inflammatory Response in a Hyperglycemic Microenvironment. International journal of molecular sciences, 24(10). doi.org/10.3390/ijms24108832.
- Li J, et al. (2023). Heme metabolism mediates the effects of smoking on gut microbiome. Nicotine & tobacco research: official journal of the Society for Research on Nicotine and Tobacco [Preprint]. doi.org/10.1093/ntr/ntad209.
- Maekawa T, et al. (2014). Porphyromonas gingivalis manipulates complement and TLR signaling to uncouple bacterial clearance from inflammation and promote dysbiosis. Cell host & microbe, 15(6), 768–778.
- Marsh PD. (1991). Sugar, fluoride, pH and microbial homeostasis in dental plaque. Proceedings of the Finnish Dental Society. Suomen Hammaslaakariseuran toimituksia, 87(4), 515–525.
- Mason MR, et al. (2015). The subgingival microbiome of clinically healthy current and never smokers. The ISME journal, 9(1), 268–272.
- Poulain D. (2015). Candida albicans, plasticity and pathogenesis. Critical reviews in microbiology, 41(2), 208–217.
- Rosier BT, et al. (2022). The Importance of Nitrate Reduction for Oral Health. Journal of dental research, 101(8), 887–897.
- Zaura E, et al. (2015). Same Exposure but Two Radically Different Responses to Antibiotics: Resilience of the Salivary Microbiome versus Long–Term Microbial Shifts in Feces. mBio, 6(6), e01693–15.