Pie herpesvīrusu dzimtas (Herpesviridae) pieder ap 200 vīrusu, kas ir patogēni cilvēkiem, gliemjiem, abiniekiem, zivīm, putniem un dzīvniekiem. Herpesvīrusu vairākums ir sugas specifiski un spēj inficēt tikai kādas noteiktas sugas saimnieku. Dzīvnieku herpesvīrusi, izņemot pērtiķa herpesvīrusu B (B virus), nav bīstami cilvēkam. Pašlaik ir atklāti astoņi cilvēka herpesvīrusi (1. tabula). B virus infekcija norit ar ādas un gļotādu bojājumu un bieži komplicējas ar smagu mielītu un encefalītu, kas bez savlaicīgas, adekvātas antivirālas terapijas ap 80% gadījumu ir fatāls.
Morfoloģija
Cilvēka herpesvīrusi morfoloģiski ir ļoti līdzīgi. Herpesvīruss ir ar biezu apvalku klāts ikosaedrs, tā diametrs ir 150-200 nm (1. attēls). Viriona nukleokapsīdu veido 162 stobrveida kapsomēri, kas pārklāj divpavedienu serdeni ar dsDNS. EM skaidri redz biezu apvalku. EM redz arī defektīvus bezapvalka herpesvīrusus ar diametru ap 100 nm (2. attēls).

1. tabula
Herpesvīrusu bioloģiskās īpašības
HSV virionā ir ap 30 struktūras pro te īnu - septiņi glikoproteīni: gB, gC, gD, gE, gF, gG un gX, kas atrodas uz vīrusa virsmas. Tie ierosina vīrusus neitralizējošu antivielu veidošanos. Kapsīdā ir seši proteīni, starp tiem arī fosfatāze un proteīnkināze. HSV replikācijas laikā sintezējas arī vairāki nestruktūras proteīni, kā timidīnkināze. Herpesvīrusi var būt neatkarīgi no saimnieka šūnām, jo spēj sintezēt daudz vīrusspecifisku fermentu, kā DNS polimerāzi. HSV-1, HSV-2 un VZV kodē timidīnkināzi, kas ietekmē pretvīrusu preparātu darbību. Daudziem herpesvīrusiem ir līdzīgi polipeptīdi, tāpēc diagnostika pēc antigēniem nav droša. Iespējamas krustotās seroloģiskās reakcijas.
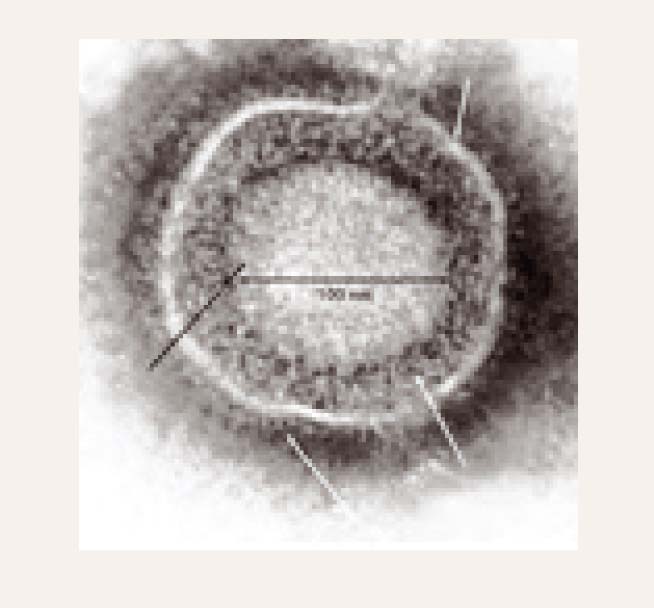

1. attēls
Herpesvīruss EM
Herpesvīrusu genoms
Herpesvīrusu genoms ir divpavedienu dsDNS lineāra molekula, kurā ir 85-240 x 106 bāzes pāru (bp). Replikācijas laikā herpesvīrusu dsDNS kļūst cirkulāra. Dažādu herpesvīrusu genomi pēc struktūras ir atšķirīgi. Herpesvīrusos izšķir vienu garu (L) un vienu īsu (S) kodējošo DNS segmentu.
Katrs segments sastāv no unikālām (UL un US) secībām ar invertētiem atkārtojumiem galos. Atkārtojumu reģionu inversija ļauj herpesvīrusiem, izņemot EBV, pastāvēt dažādās izometriskās formās. Atkārtoto secību dēļ iespējama DNS lineārās struktūras pārveidošanās cirkulārā, kas ir nepieciešama replikācijas procesā. Produktīvās lītiskās infekcijas cikla laikā lielais herpesvīrusu genoma apjoms dod iespēju uz DNS sin tezēt no 70 līdz 150 proteīnu. Puse no herpesvīrusu proteīniem ir funkcionāli (nestrukturāli; regulējoši) un piedalās vīrusu replikācijā, pārējie ir strukturālie proteīni.
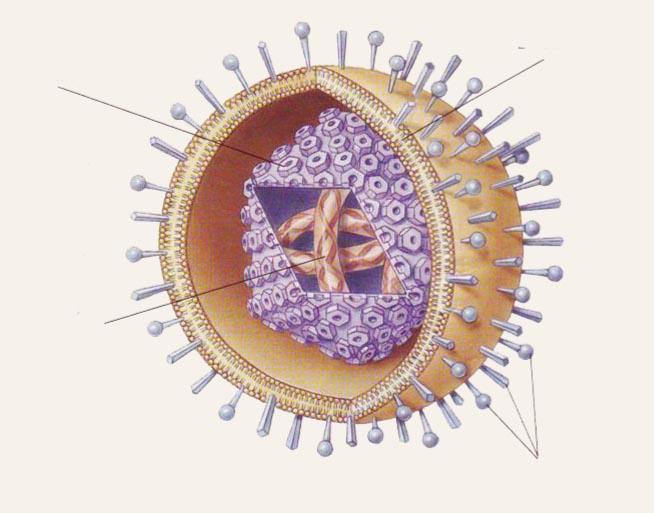

2. attēls
Herpesvīrusu shematiska struktūra
Herpesvīrusu replikācija
Herpesvīrusu replikācija sākas ar to adsorbciju pie saimnieka šūnu receptoriem. Tad seko herpesvīrusu endocitoze ar vīrusa un šūnas membrānas saplūšanu. Šūnas citoplazmā iekļūst kapsīds bez apvalka un migrē uz kodolu. Mērķšūnas kodolā notiek herpesvīrusu replikācija. Jaunsintezētais tukšais nukleokapsīds ietver jauno vīrusa DNS, kas mijiedarbojas ar DNS saistīto vīrusa proteīnu un, pumpurojoties caur šūnas kodola membrānu, iegūst iekšējo apvalku, bet, šķērsojot šūnas membrānu, - ārējo apvalku.
Herpesvīrusa gēnu ekspresija notiek pakāpeniski. Agrīno vī russpecifisko proteīnu - to vidū arī vīrusa ribonukleotīdu reduktāzes, timidīnkināzes un DNS polimerāzes - sintēze notiek pirms DNS replikācijas. Vēlīnie herpesvīrusa proteīni sintezējas pēc vīrusa DNS replikācijas. To vidū ir arī galvenais kapsīda peptīds un glikoproteīns gC. Vīrusa gēnu transkripciju ierosina šūnas RNS polimerāze II. Istabas temperatūrā herpesvīrusi ir relatīvi nestabili (termolabili), tos ļoti ātri inaktivē organiskie šķīdinātāji un deterģenti.
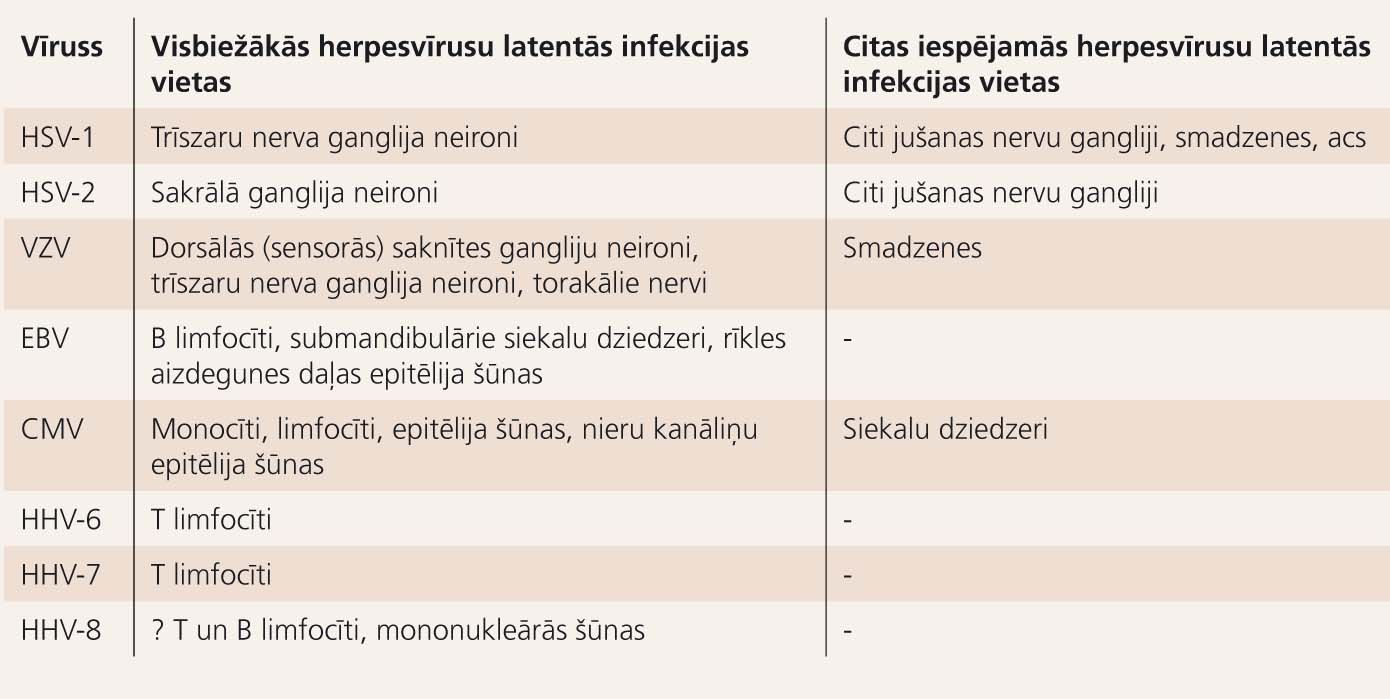

2. tabula
Dažādu herpesvīrusu latentās infekcijas vietas
Herpesvīrusu klasifikācija
Herpesvīrusus, salīdzinot to genomu radniecības pakāpi, dala trīs ģintīs (2. tabula):
I. Alphaherpesvirinae, pie kuras pieder Herpes simplex vīruss-1 un Herpes simplex vīruss-2 (HSV-1, HSV-2; HHV-1, HHV-2), kā arī
Varicella zoster vīruss (VZV, HHV-3).
II. Betaherpesvirinae ietver cilvēka citomegalovīrusu (CMV; HHV-5), cilvēka herpesvīrusu-6 un cilvēka herpesvīrusu-7 (HHV-6, HHV-7).
III. Gammaherpesvirinae pieder Epšteina-Barra vīruss (EBV; HHV-4) un cilvēka herpesvīruss-8 (HHV-8); (3. tabula).
Herpesvīrusu infekcija klīniski izpaužas neparasti daudzveidīgi - no izsitumiem uz lūpām līdz ģeneralizētai slimībai, iedzimtām anomālijām un ļaundabīgiem audzējiem. Herpesvīrusu izraisītās slimības var būt sporādiskas, gan arī noritēt kā epidēmiski uzliesmojumi. Beta un gamma herpesvīrusi reproducējas limfātiskajos audos; tie ir limfotropi.
Gamma herpesvīrusi ne vienmēr izraisa saimnieka šūnas bojāeju, bet veicina to proliferāciju, tāpēc šiem vīrusiem ir būtiska nozīme ļaundabīgo audzēju veidošanās procesā. Gamma herpesvīrusi inducē limfoproliferatīvas slimības, kā Berkita limfomu afrikāņiem, nāzo-faringeālu karcinomu ķīniešiem, ne-Hodžkina limfomu, Kapoši sarkomu - (HHV-8) AIDS slimniekiem, kā arī invazīvu krūts karcinomu.
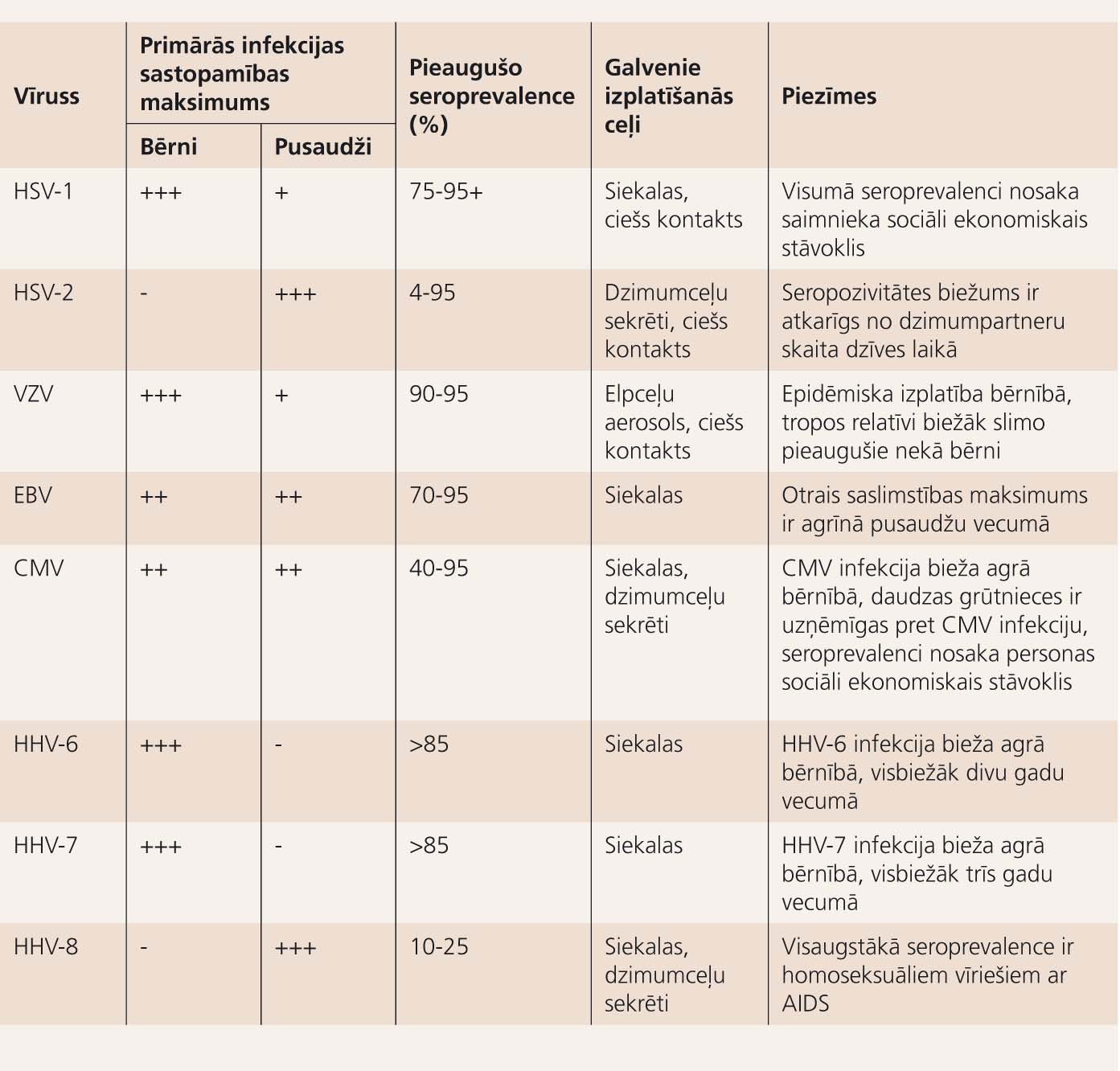

3. tabula
Herpesvīrusu infekciju raksturīgās īpatnības
Izteikta destruktīva patoloģija (citolīze) vairāk raksturīga alfa herpesvīrusiem - HSV un VZV (4. tabula).
Vienkāršie herpesvīrusi (HSV): HHV-1 un HHV-2
Vēsture
Herpes simplex vīrusu pirmo reizi izolēja 1912. gadā no lūpu herpētiskajiem bojājumiem. HSV infekcijai raksturīgos ieslēguma ķermeņus inficētajās šūnās noteica un aprakstīja 1934. gadā. Pirmo herpesvīrusu nomenklatūru radīja 1954. gadā (4. attēls).
HSV-1 un HSV-2 morfoloģija
HSV-1 un HSV-2 pieder pie alfa herpesvīrusiem. To DNS nukleotīdu sekvences ap 50% sakrīt.
HSV-1 un HSV-2 atšķiras pēc viriona proteīnu antigēnu struktūras un DNS homoloģijas pakāpes, kā arī pēc termostabilitātes, jutības pret 5-jododioksiuridīnu un interferonu (ITF).
HSV viriona diametrs ir 186-225 nm, un tas ir veidots no četriem struktūras elementiem.
Serde (core) atrodas nukleokapsīda centrā, un to veido lineāra divpavedienu dsDNS molekula 100 x 106 bp (bāzu pāru) garumā. Tā diametrs ir ap 77 nm. Kovalenti saistīti komponenti L un S satur unikālas nukleotīdu secības, kā arī taisnās un apgrieztās atkārtotās secības, kuru pozīcija mainās vīrusu replikācijas laikā, ko dēvē par DNS izomēriju. Lineārā HSV ds DNS ak tī vas her pesvī ru su replikācijas laikā kļūst cirkulāra.
Ikosaedriskā nukleokapsīda diametrs ir ap 125 nm. Nukleokapsīds sastāv no 162 kapsomēriem, 150 heksoniem un 12 pentoniem.
Ārējais apvalks - superkapsīds sastāv no saimnieka šūnu kodola membrānas lipīdu dubultslāņa un satur vairāk nekā desmit herpesvīrusu apvalkā inkorporētu HSV kodētu glikoproteīnu.
Amorfajā slānī (tegument), kas atrodas starp apvalku un serdi, izšķir 15-20 strukturālo proteīnu, kas aktivizē HSV replikāciju. Galvenais no tiem ir alfa transinducējošā faktora proteīns (alfa-TIF proteīns jeb VP16), kura galvenā funkcija ir pastiprināt tūlītēju herpesvīrusu transkripciju pēc HSV mijiedarbības ar saimnieka šūnas proteīniem.
Visus herpesvīrusu proteīnus dala:
- vīrusa apvalka glikoproteīnos - GP;
- viriona proteīnos - VP;
- nukleokapsīda proteīnos - NC;
- inficēto šūnu proteīnos - ICP.
Šo HSV komponentu izvietojumu kodē DNS UL un US secības. HSV proteīnus sauc arī atkarībā no kodējošās secības: ICP 1/2 vai UL36.
Liela nozīme ir HSV regulējošiem proteīniem a4 un aO, kā arī latento infekciju determinējošam proteīnam, piemēram, LAT (latency associated transcript). Vēl viena regulējošo proteīnu klase ietver trīs a proteīnus: UL46 un UL47 proteīnus, kas kontrolē a-TIF proteīna aktivitāti, UL41 saistīts ar virionu un destabilizē iRNS molekulas inficētajās saimnieka šūnās. Galvenais a proteīns, kas saistīts ar DNS, ir UL29, tas piedalās herpesvīrusu DNS replikācijā.
Replikācija
Alfa herpesvīrusiem ir īss replikācijas cikls. Tas sākas ar herpesvīrusa adsorbciju ar sava apvalka glikoproteīnu (antireceptoru) pie mērķšūnas specifiskā receptora.
Specifiskos receptorus uz mērķšūnas virsmas, pie kuriem adsorbējas herpesvīruss, agrāk dēvēja par herpesvīrusa ieejas mediatoriem. Tie atrodas uz dažādu šūnu virsmas un pieder pie šūnu proteīniem, kas mijiedarbojas arī ar audzēja nekrozes faktoru (TNF) un poliovīrusu antireceptoriem.
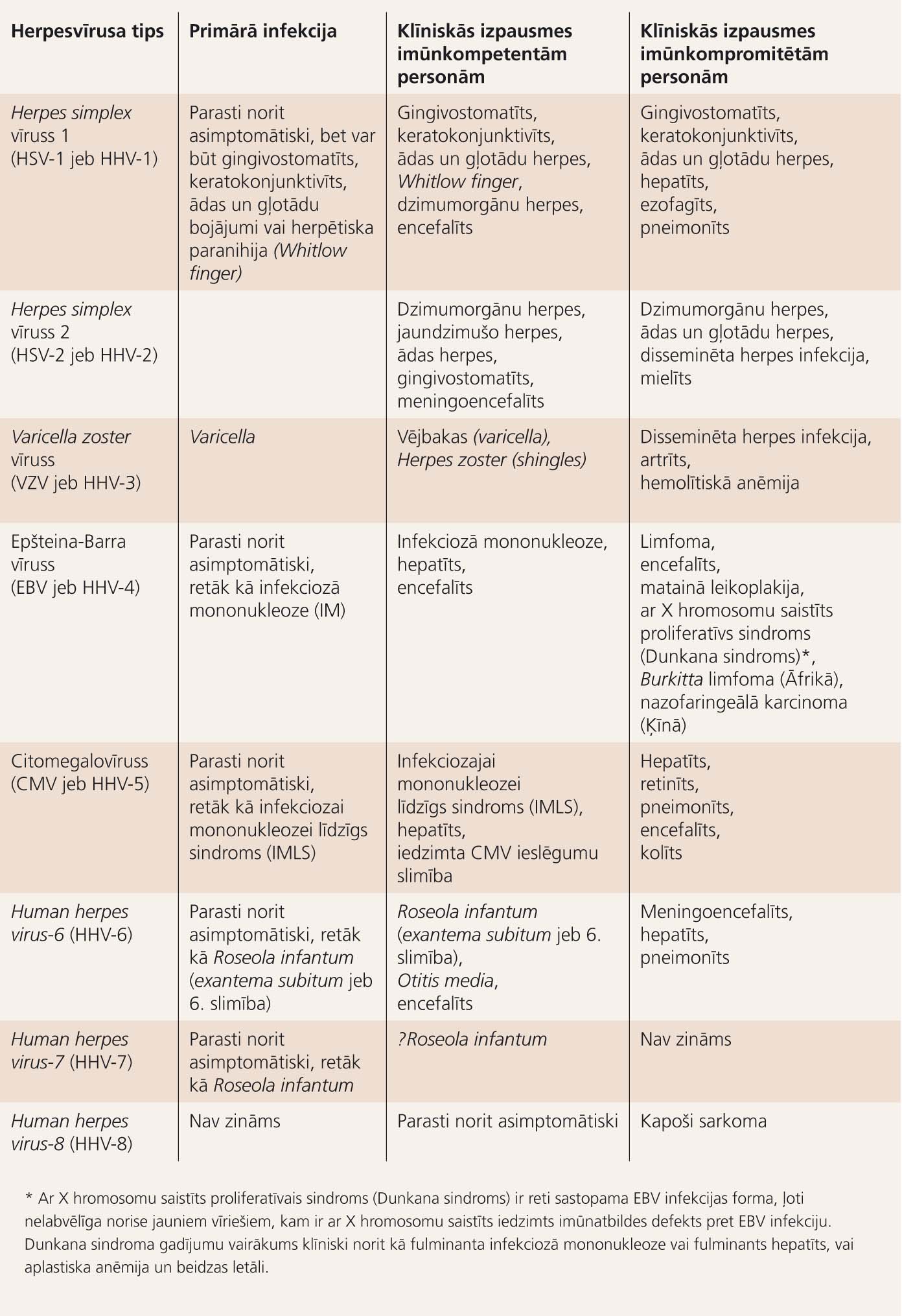

4. tabula
Cilvēka herpesvīrusi un to izraisītās slimības un sindromi
Pēc penetrācijas un izģērbšanās no herpesvīrusu superkapsīda atbrīvojas serde, kas dodas uz mērķšūnas kodolu. Mērķšūnas kodolā notiek herpesvīrusu replikācija, t. i., to ģenētiskās programmas realizācija.
Mērķšūnas kodolā notiek herpesvīrusu tūlītējo, agrīno un vēlīno gēnu transkripcija un translācija. Herpesvīrusu tegumenta proteīns ierosina piecu tūlītējo herpesvīrusu gēnu ekspresiju. Tie aktivē agrīnos gēnus, kas producē faktorus, kuri nepieciešami herpesvīrusu DNS replikācijai. Vēlāk herpesvīrusu replikācijas procesā iekļaujas vēlīnie herpesvīrusu gēni, kas kodē citus svarīgus viriona proteīnus.
Herpesvīrusu jaunsintezētās nukleokapsīda subvienības koncentrējas pie mērķšūnas kodola membrānas, kur notiek jauno HSV montāža. Kodola membrānā iepriekš iekļaujas glikolizētie herpesvīrusu apvalka glikoproteīni. Šis mērķšūnas kodola membrānas fragments aptver jaunsintezēto herpesvīrusa kapsīdu, un tas no kodola pumpurojas, graudainajā endoplazmatiskajā tīklojumā iegūstot saimnieka šūnas kodola apvalku. Daļa Goldži aparātā nobriedušo virionu ar eksocitozes palīdzību atbrīvojas no saimnieka šūnas.
Citi herpesvīrusi nepabeidz replikācijas ciklu un uzreiz adsorbējas pie blakus šūnas un sāk jaunu replikācijas ciklu. Vietu, kur veidojas nukleokapsīdi, dēvē par viroplastu. Viroplasti lokalizējas mērķšūnu kodolā pie kodola membrānas. Herpesvīrusi ierosina kontaktējošo blakus šūnu saplūšanu, un izveidojas daudzkodolu gigantiskas šūnas (simplasti), kas ir herpesvīrusiem raksturīgs citopatogēnais efekts (CPE) mērķšūnās. Simplasti nav dzīvotspējīgi, visas to veidojošās šūnas ātri iet bojā. Svarīgi atcerēties, ka simplastā ieslēgtos herpesvīrusus specifiskās anti-HSV antivielas nespēj neitralizēt. Simplasta veidošana ir veids, kā HSV izvairās no imūnatbildes.
Imūnatbilde
HSV infekcija inducē imūnatbildes reakciju, kurā izšķir:
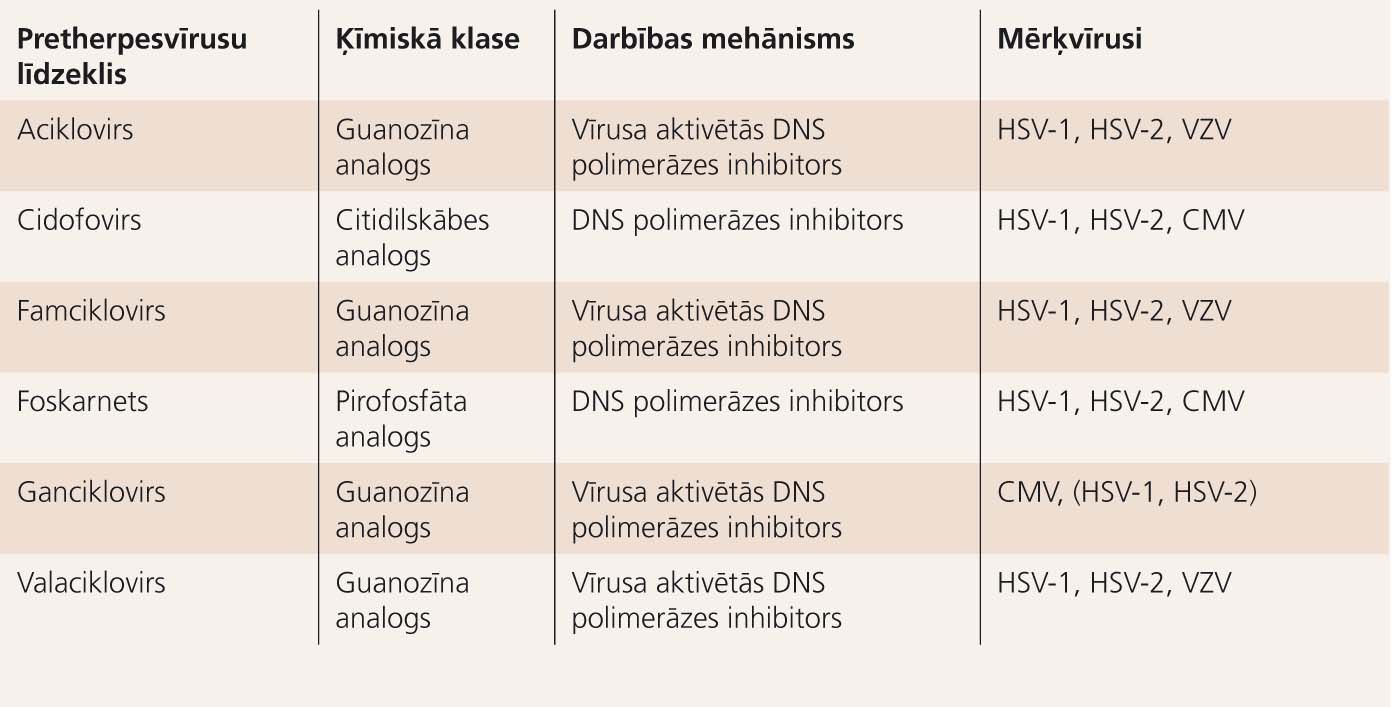

5. tabula
Pretherpesvīrusu medikamenti
- agrīno nespecifisko imūnatbildi agrīnajā HSV infekcijas stadijā (nodrošina ap 10% aizsardzības) un
- vēlīno specifisko imūnatbildi uz HSV infekciju vēlīnajā HSV infekcijas stadijā.
Dabiskās galētājšūnas (NK) un interferons (IFN) ir galvenie nespecifiskās imunitātes aizsardzības faktori pret HSV infekciju. Langerhansa šūnām (ādas makrofāgiem) ir liela nozīme ādas HSV infekcijas kontrolē. HSV infekcijas norise, klīniskās izpausmes un smagums saistīti arī ar saimnieka MHC (Major Histocompatibility Complex) un HLA (Human Leukocyte Antigenes) īpašībām. Saimnieka HLA-A1, A2, A9, BW16 un CW2 saistīti ar herpētiskiem mutes dobuma bojājumiem, bet HLA-A1, A2, A9 un DR3 - predisponē saimnieku herpesvīrusu izraisītām acu infekcijām.
Specifiskajā imūnatbildē izšķir hu morālo un šūnu imūnatbildes reakcijas. HSV specifiskās antivielas konstatē piektajā līdz desmitajā dienā pēc inficēšanās ar herpesvīrusiem, un tās saglabājas ilgu laiku. Antivielu titrs ir augstāks personām ar herpesvīrusu latentās infekcijas aktivāciju. Antivielas pret herpesvīrusu apvalka glikoproteīniem - gD, gB, gE, gGl /gG2, gC - un tūlītējo proteīnu IE175 dominē pacientiem ar primāru herpesvīrusu infekciju. Antivielas pret herpesvīrusu kapsīda proteīniem atrod personām ar latentās herpētiskās infekcijas aktivāciju.
Bērniem antivielas pret IE175 liecina par ilgstošu herpesvīrusu infekciju. Ar herpesvīrusiem inficētiem jaundzimušajiem atrod IgA antivielas, vairāk pret herpesvīrusu apvalka Ag - gD. Tās atrod pirmajās trijās herpesvīrusu infekcijas nedēļās. Anti-HSV, ko auglis saņem no mātes caur placentu, nepietiekami aizsargā jaundzimušo pret HSV infekciju.
Specifisko šūnu imūnatbildi pret herpesvīrusu infekciju nodrošina T limfocīti un antigēnu prezentējošās šūnas (APC). Jaundzimušajiem, salīdzinot ar pieaugušiem, specifiskā T šūnu imūnatbilde pret HSV-1 un HSV-2 infekciju attīstās ar kavēšanos - tikai otrajā līdz ceturtajā nedēļā, un tajā ir pazemināta alfa-IFN un gamma-IFN producēšana. Tā skaidro, kāpēc jaundzimušajiem ir smagāka herpesvīrusu infekciju norise.
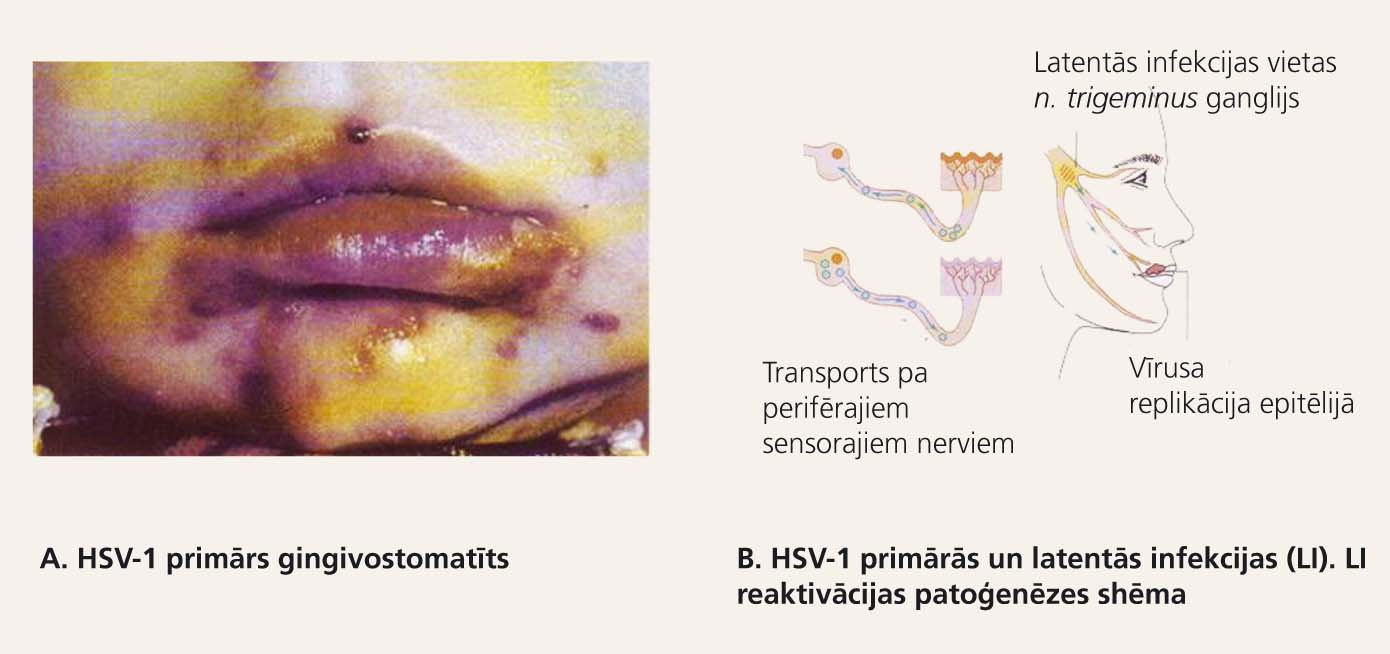

3. attēls
HSV-1 primārās un latentās infekcijas
Atšķirībā no citu vīrusu izraisītajām infekcijām, CD8 (CTL) imūnatbilde pret HSV-1 un HSV-2 infekciju ir kavēta. HSV-1 specifiskie CTL kloni vēršas pret apvalka glikoproteīniem gB, gD vai gE, bet HSV-2 specifiskie CTL kloni - pret gC, gD, gE vai gG. Raksturīgi, ka pat laba imūnatbilde pret primāro herpesvīrusu infekciju nepasargā saimnieku no turpmākas latentas herpesvīrusu infekcijas mūža garumā, kā arī tās reaktivācijas.
Visiem herpesvīrusiem ir ļoti raksturīgi, ka pēc primārās infekcijas saimnieks nespēj tos pilnīgi eliminēt un attīstās latenta infekcija (latency) turpmākā mūža garumā. Dažādu herpesvīrusu latentās infekcijas vietas uzskaitītas 2. tabulā.
Herpesvīrusu latentās infekcijas reaktivāciju izraisa dažādi stresa faktori (aukstums, insolācija, infekcija u. c.). Herpesvīrusu reaktivācija bieži saistīta ar T limfocītu imūnatbildes traucējumiem. Ādas makrofāgi, kas pastiprināti producē prostaglandīnu E2, nomāc T šūnu imūnatbildi un veicina HSV latentās infekcijas reaktivāciju.
Patoģenēze
HSV pēc primārās replikācijas inficētajās šūnās ieejas vārtos pārvietojas retrogrādi pa nerviem un nokļūst reģionālajos nervu sistēmas ganglijos, un latenti tur persistē saimnieka mūža garumā. HSV infekcijas latentajā periodā HSV dsDNS pastāv cirkulāras episomas formā. Dažādi stresa faktori, kā aukstums, insolācija, infekcija u. c., var izraisīt HSV latentās infekcijas reaktivāciju. Tad HSV sāk vairoties NS ganglijos, ortogrādi pa nerviem tas nokļūst dažādos orgānos un var izraisīt smagas komplikācijas (encefalītu, mielītu, keratītu).
Latentas HSV infekcijas reaktivācija notiek ātri - trīs līdz piecu dienu laikā pēc dažādu stresa faktoru iedarbības. HSV genoma produkti sāk aktivēt vīrusspecifisko faktoru, kā timidinkināzes un ribonukleotīdreduktāzes, tūlītējo proteīnu IE110 (immediate early), kā arī HSV-1 genoma produktu LAT (latency associated transcript) izdalīšanos latenti ar HSV inficētos reģionālos neironos. HSV reaktivācijas stimuls ir jebkurš nespecifisks stresors, kā aukstums, drudzis, ultravioletais starojums utt. Daudz biežāk HSV DNS ilgstoši saglabājas jušanas nervu ganglijos latentā formā un nereplicējas. HSV-1 ieejas vārti biežāk ir mutes un rīkles gļotāda. HSV-1 vieta, kur tas saglabājas kā latenta infekcija, ir Nervus trigeminus ganglijs. HSV-2 ieejas vārti parasti ir dzimumorgāni. HSV-2 vieta, kur tas saglabājas kā latenta infekcija, ir krustu jušanas nervu ganglijs.
Izplatīšanās
HSV iekļūst saimnieka organismā caur ādu vai gļotādu. Āda, gļotādas un siekalas ir primārās HSV-1, HSV-2 infekcijas svarīgākie avoti. HSV-1 infekcijas ģenitāla forma nav bieža. HSV-1 infekciju uz ģenitālijām pārnes orāla dzimumakta laikā. HSV-2 ir plaši izplatīta STS, un parasti tā izplatās dzimumakta laikā. HSV-2 pacientiem ar STS izolē bieži:
- asimptomātiskiem vīriešiem no uroģenitālā trakta 0,4%-5%;
- asimptomātiskām sievietēm 2%-7%.
Apkārtējā vidē HSV-1 un HSV-2 ir nestabili, tāpēc inficēšanās var notikt tikai ciešas saskares gadījumā.
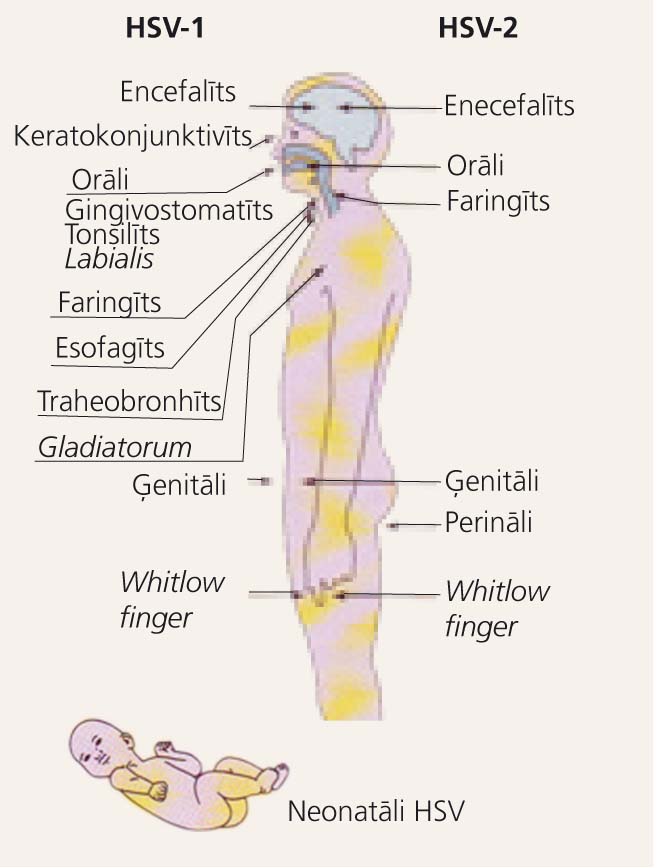

4. attēls
HSV-1 un HSV-2 bojājumi
Epidemioloģija
HSV infekcija ir plaši izplatīta, un saslimstība nav saistīta ar gadalaiku. Ap 30% iedzīvotāju jaunattīstības valstīs antivielas pret HSV-1 parādās līdz piecu gadu vecumam. Tās ir atrodamas ap 80% pusaudžu. Milzīgais personu skaits ar latento HSV infekciju dod tai iespēju ātri izplatīties kontakta ceļā (3. attēls).
Ņujorkā ar HSV-2 ir inficējies katrs ceturtais pieaugušais. HSV-2 izplatīšanos būtiski ietekmē šādi saimnieka faktori:
- rase (negroīdiem daudz biežāk nekā eiropiešiem);
- dzimums (sievietēm biežāk nekā vīriešiem);
- dzimumpartneru skaits mūža garumā (jo vairāk seksuālo partneru, jo lielāks inficēšanās risks ar HSV-2);
- ģimenes stāvoklis (neprecētām personām biežāk nekā precētām);
- dzīvesvieta (lielpilsētu iedzīvotājiem daudz biežāk nekā lauku iedzīvotājiem).
Ap 1% grūtnieču ir inficētas ar HSV-2. Grūtniecēm, kam piedzima ar HSV-2 inficēts bērns, HSV-2 infekcija ap 70% gadījumu bija latenta. Tas vēlreiz apstiprina visiem zināmo patiesību, ka prevalējošās ir subklīniskās, bezsimptomu un latentās infekcijas procesa formas.
Viena gada laikā HSV-1 izraisīts encefalīts sastopams apmēram trim personām no viena miljona. Sporādisko encefalītu visbiežāk izraisa HSV-1, tas norit ļoti smagi, un, ja to agrīni nediagnosticē un ļoti enerģiski agrīni neārstē ar lielām aciklovira devām, slimnieks nomirst. Aseptiskā meningīta slimniekiem HSV-2 izolē reti, tikai ap 2%. Saslimstība ar HSV-1 infekciju pieaug piecu līdz 30 gadu grupā un vecākiem par 50 gadiem. Prevalē HSV-1 infekcija, to diagnosticē 95% gadījumu.
Klīniskā aina
Ar HSV-1, HSV-2 inficējas gan bērni, gan pieaugušie. Šīs infekcijas var izplatīties arī vertikāli, transplacentāri no inficētās mātes uz bērnu. HSV-1, HSV-2 var izraisīt plašu dažādu slimību spektru. Inkubācijas periods svārstās no vienas līdz 26 dienām, vidēji ir septiņas dienas. Prevalējošās ir subklīniskās, bezsimptomu un latentās HSV infekcijas formas. HSV infekcija daudz retāk izraisa manifestu saslimšanu, kuras norise dažkārt ir smaga un dod fatālas komplikācijas. Slimības norisi ietekmē pacienta ģenētiskie faktori, imūnsistēmas stāvoklis, vecums, dzimums, blakusslimības un vīrusa tips.
Ap 80% gadījumos bērniem HSV-1 primārā infekcija norit bez klīniskām pazīmēm. Vēlāk viņiem var būt latentās HSV-1 infekcijas reaktivācija ar lielāku vai mazāku klīnisku simptomātiku.
Bērniem viena līdz trīs gadu vecumā HSV-1 infekcija visbiežāk izpaužas kā gingivostomatīts ar vezikuloziem izsitumiem uz sejas un lūpām. Bērniem var būt drudzis, paaugstināta temperatūra, gingivīts un kakla limfodenopātija.
Vecākiem bērniem HSV-1 infekcija parasti norit kā elpceļu in fekcija (ARVS) un/vai faringīts.
HSV-1 reaktivācija parasti norit ar pūslīšu veidošanos uz lūpām, kuri pāriet četru līdz septiņu dienu laikā. HSV-1 primārā infekcija var izpausties kā akūts rinīts. Tad pūslīši ir uz deguna dobuma gļotādas, ko pavada kak la limfadenopātija. HSV-1 var izraisīt arī dažādas ādas u. c. slimības:
- pirksta distālās falangas mīksto audu herpētiskais iekaisums (Whit low finger). Tas biežāk skar stomatologus, slimnīcas personālu;
- primāro herpētisko dermatītu ar ģeneralizētu vezikulāru eksantēmu;
- herpes ekzēmu, kas parasti ir primārās infekcijas manifestācija, kad āda ir infekcijas ieejas vārti;
- traumatisko herpesu, kas skar apdegušu, noberztu, traumētu ādu;
- HSV-1 infekcija dažkārt var izraisīt fatālu encefalītu un keratokonjunktivītu, kas var izsaukt pat redzes zudumu.
HSV-1, HSV-2 un grūtniecība
Primāra HSV-1, HSV-2 dzimumorgānu infekcija ir bīstama grūtniecei un bērnam. Īpaši smagi HSV infekcija norisinās grūtniecēm ar dažādas etioloģijas imūndeficītu. Grūtnieču un augļa mirstība ir ap 50%.
Grūtniecēm ar primāro HSV-1, HSV-2 infekciju pirmajās 20 nedēļās 25% gadījumu notiek spontāns aborts. Bērns parasti inficējas dzemdību ceļos. Atšķirībā no HSV infekcijas pieaugušiem, jaundzimušo HSV infekcija vienmēr ir ļoti nopietna un norit ar plašiem ādas un gļotādu bojājumiem, nekrotiskām pārmaiņām dažādos orgānos un CNS. Ap 70% gadījumu neārstēta neonatāla HSV-1, HSV-2 infekcija var pāriet bez smagām komplikācijām, bet vēlāk bērniem var būt garīgās attīstības traucējumi.
HSV-1, HSV-2 infekcija reti bojā aizkuņģa dziedzeri, tievās un resno zarnu, kā arī kaulu smadzenes.
Laboratoriskā diagnostika
Ar HSV-1 un HSV-2 var inficēt eksperimenta dzīvniekus. Jūrascūciņas ir lieliski modeļi primārās dzimumorgānu infekcijas pētīšanai, bet peles un truši HSV latentās infekcijas un reaktivācijas pētīšanai.
HSV-1 un HSV-2 var pierādīt visos organisma šķidrumos un audos: noteikt asinīs, spermā, urīnā, likvorā, bronhoalveolārā šķidrumā, dzemdes kakla (Pap uztriepēs), nazofaringeālās un konjunktīvas uztriepēs (Tzank uztriepēs), kā arī biopsijas materiālā (nav pietiekami jutīga).
- Ar gaismas mikroskopiju citoloģiskos preparātos var redzēt raksturīgus HSV-1, HSV-2 infekcijas iecirkņus ar daudzkodolu gigantiskām šūnām (simplasti), un to kodoli satur acidofilas daļiņas (Cowdrey body).
- Ar elektronmikroskopu var vizualizēt HSV virionus.
- Vīrusu var kultivēt epiteliālo, parasti trušu nieru šūnu kultūrā un vērtēt pēc citopātiskā efekta (CPE). Šī metode nav pietiekami jutīga asimptomātiskai personai vai slimniekam ar zemu HSV titru.
- Imūnfluorescences metodes var izmantot kā antivielu (Ab), tā arī antigēnu (Ag) pierādīšanai. Šo metožu jutīgums antigēna noteikšanas gadījumā ir 70-90%, ja paraugs ir no pacienta ar dzimumorgānu vai mutes izsitumiem agrīnā stadijā. Daudz mazāks jutīgums antigēna noteikšanai ir uztriepēs no dzemdes kakla vai citos paraugos no asimptomātiskas personas.
- Seroloģiskās analīzēs var noteikt HSV specifiskās IgM, IgG, IgA. Tās ir noderīgas tikai primārās HSV infekcijas diagnostikai, kad notiek serokonversija, un jāņem vērā, ka tās neatšifrē HSV tipu. Slimniekiem ar HSV-1 vai HSV-2 infekciju reaktivāciju gļotādā vai ādā anti-HSV titrs parasti nepieaug. Anti-HSV IgM līmeņa salīdzināšana var būt efektīva imūnsupresīvās terapijas monitoringam, lai noteiktu HSV reaktivācijas risku. Anti-HSV IgM, kā arī anti-HSV IgG var iztrūkt gan pri māras, gan reaktivētās HSV infekcijas gadījumā.
- Imūnfermentatīvās metodes arī var lietot Ab un Ag noteikšanai. Šīs metodes labāk izmantot slimniekiem ar klīnisku simptomātiku, un ir jāsalīdzina titri akūtajā un rekonvalescences periodā.
- HSV apvalka glikoproteīnu noteikšana likvorā ir efektīva dzīvību apdraudošā HSV encefalīta diagnostikā.
- HSV-1, HSV-2 DNS var noteikt visos iepriekš minētajos paraugos ar in situ DNS hibridizācijas metodi.
- Polimerāzes ķēdes reakcija (PĶR; PCR) un tās modifikācijas.
- Rapid-Cycle Real-Time PCR ir ļoti ātri veicama, ļoti specifiska un ļoti jutīga diagnostikas metode, ko arvien plašāk lieto klīniskajā mikrobioloģijā.
Ārstēšana un profilakse
Terapijas iespējas uzskaitītas 5. tabulā.
Aciklovirs (ACV) ir pretvīrusu līdzeklis, kas inhibē vīrusa specifisko timidīnkināzi.
Acikloviru lieto, lai mazinātu HSV slodzi un atvieglotu lokālos un sistēmiskos simptomus kā orālās, tā arī ģenitālās infekcijas gadījumā. Šis preparāts ir diezgan efektīvs HSV encefalīta (efektīvs tikai tad, ja lieto agrīni) un atkārtotu dzimumorgānu infekciju ārstēšanai. Slimniekiem ar imūndeficītu ilgstoša terapija, lai novērstu smagu HSV infekciju, var beigties ar ACV rezistenci. Foskarnets ir alternatīvs preparāts, kas tieši inaktivē vīrusa polimerāzi, un ieteicams gadījumos, kad ACV nepalīdz. ACV parasti izmanto neonatālās infekcijas terapijā. Acu infekcijas labi var ārstēt ar trifluorotimidīnu, jododezoksiuridīnu, ACV un vidarabīnu.
Efektīva vakcīna pret HSV pagaidām nav radīta.