Hronisku obstruktīvu plaušu slimību raksturo produktīvs klepus ar krēpām un progresējošs elpas trūkums. Patoloģijas pamatā ir obstruktīvi plaušu ventilācijas traucējumi un hroniska iekaisuma reakcija elpceļos. [2]
Pēc PVO datiem HOPS ir ceturtais biežākais nāves cēlonis pasaulē. [3] Aptuveni 10 % indivīdu, kas vecāki par 40 gadiem, ir diagnosticēta HOPS, lai gan izplatība dažādās valstīs atšķiras un pieaug līdz ar vecumu. Augsto sastopamības rādītāju un hroniskā rakstura dēļ HOPS izraisa ievērojamu veselības aprūpes resursu patēriņu, biežas vizītes pie ārstiem, atkārtotu hospitalizāciju akūtu paasinājumu dēļ un nepieciešamību pēc ilgstošas terapijas. [4]
Rakstā divās daļās (februārī un martā) apskatītas biežākās HOPS komplikācijas: akūts slimības paasinājums, policitēmija, hroniska elpošanas mazspēja un plaušu hipertensija. Marta Doctus numurā rakstam pievienosies torakālā ķirurga komentārs par ķirurģiskām komplikācijām un ģimenes ārsta skatījums par sadarbību ar pacientu un inhalatoru lietojumu HOPS pacientiem.
HOPS — akūts paasinājums
1987. gadā Antonisens un kolēģi [5] piedāvāja definīciju, kas pēdējos 35 gadus palikusi gandrīz nemainīga un veido pamatu gan Eiropas Elpošanas biedrības/Amerikas Torakālās biedrības, gan Globālās hroniskas obstruktīvas plaušu slimības iniciatīvas (GOLD) definīcijai, [6] kur HOPS paasinājums definēts kā “elpas trūkums un/vai klepus ar krēpām, kas pasliktinās pēdējās ≤ 14 dienās, ko var pavadīt tahipnoja un/vai tahikardija un kas bieži ir saistīts ar pastiprinātu lokālu un sistēmisku iekaisumu, ko izraisa elpceļu infekcija, piesārņojums vai citas elpceļu slimības”. [2]
Pētījumu dati liecina, ka...
- HOPS paasinājumi negatīvi ietekmē pacienta veselības stāvokli, palielina atkārtotas hospitalizācijas risku un veicina slimības progresēšanu. [2]
- Pacientiem ar HOPS paasinājumu ir palielināts citu akūtu notikumu risks, īpaši sirds mazspējas dekompensācijas, pneimonijas, plaušu artēriju trombembolijas. [2]
- HOPS pacientiem slimības paasinājumu biežumu ietekmē slimības smaguma pakāpe. Dažiem pacientiem paasinājumi ir biežāk, neatkarīgi no citiem slimības smaguma pakāpes rādītājiem. [7]
- Paasinājumu skaits gada laikā tieši palielina paasinājumu risku tuvākajos desmit gados. [8]
- Neatliekamā medicīniskā palīdzība HOPS paasinājuma dēļ nepieciešama 10—25 % pacientu, 5—10 % tiek hospitalizēti. [9]
- HOPS paasinājuma dēļ hospitalizētajiem pacientiem par 64 % palielinās risks atkārtotai stacionēšanai turpmākā gada laikā. [10]
HOPS paasinājumu biežākie izraisītāji [11]
1. Vīrusu izraisītas elpceļu infekcijas: visbiežākais HOPS paasinājuma cēlonis:
- rinovīruss — visbiežāk,
- citi: SARS–CoV–2, gripa, RSV, paragripa, metapneimovīruss, adenovīruss.
2. Bakteriālas infekcijas: Haemophilus influenzae, Moraxella catarrhalis, Streptococcus pneumoniae u.c. Pseudomonas aeruginosa infekcijas riska faktori ir progresējoša HOPS, iepriekšējās hospitalizācijas, sistēmiska glikokortikoīdu lietošana, iepriekšēja P. aeruginosa izolācija.
Pneimonija bieži pavada akūtu paasinājumu un var būt paasinājuma cēlonis. HOPS pacientiem imūnsistēma bieži ir novājināta, tāpēc elpceļi kļuvuši uzņēmīgāki pret patogēniem. Viens no faktoriem, kas veicina imūnsupresiju, ir kortikosteroīdu lietošana. [12; 13] Imūnās aizsardzības pavājināšanās un elpceļu strukturālās izmaiņas HOPS pacientiem veicina patogēnu ilgstošu kolonizāciju elpceļos. Šīs izmaiņas ietver elpceļu epitēlija bojājumus un ciliārā klīrensa traucējumus, kas samazina spēju izvadīt baktērijas un vīrusus no elpceļiem. [14] Smēķēšana un gaisa piesārņojums vēl vairāk pastiprina elpceļu iekaisumu un palielina risku pnei-monijas attīstībai. [15] Biežākie pneimoniju (un paasinājuma) izraisītāji ir Haemophilus influenzae, Streptococcus pneumoniae un Moraxella catarrhalis. Vīrusu infekcijas, īpaši gripas un RSV, arī būtiski veicina infekciju risku. [16]


1.tabula
Paasinājumu riska faktori
Pneimonijas simptomi HOPS pacientiem var būt nespecifiski un bieži pārklājas ar HOPS paasinājuma pazīmēm, apgrūtinot diagnostiku. Parastās pazīmes ir pastiprināts klepus, palielināta krēpu produkcija, kas var būt dzeltenas vai zaļas, kā arī elpas trūkums un zems skābekļa līmenis asinīs. [17] Drudzis un drebuļi ir bieži simptomi, taču gados vecākiem pacientiem tie var būt mazāk izteikti. [18] Pneimonijas diagnostika HOPS pacientiem neatšķiras no vispārējiem pneimonijas diagnostikas principiem. Paasinājuma riska faktori apkopoti 1. tabulā.
Diagnostika
Ja radušās aizdomas par HOPS paasinājumu, mērķis ir apstiprināt diagnozi, noteikt cēloni (ja iespējams), novērtēt elpošanas traucējumu smagumu un blakusslimību ietekmi, kā arī izslēgt alternatīvas diagnostikas iespējas.
Galvenie izvērtēšanas rādītāji:
- vitālie rādītāji un fizikālā izmeklēšana (SpO2, EF, SD, auskultācija),
- arteriālo asins gāzu analīze — hipoksēmijas/hiperkapnijas izvērtēšana,
- radioloģija — Rtg vai DT krūškurvim, lai izslēgtu pneimoniju, pneimotoraksu, plaušu tūsku, hidrotoraksu,
- laboratoriskie izmeklējumi (pilna asins aina un bioķīmija: seruma elektrolīti, glikoze, CRO utt.),
- elektrokardiogramma aritmiju un miokarda išēmijas novērtēšanai,
- mikrobioloģiskie izmeklējumi, lai noteiktu ierosinātājus, — krēpu uzsējumi, nazofaringeālā iztriepe,
- papildu izmeklējumi, lai izslēgtu komplikācijas un/vai diferenciālās diagnozes:
- plaušu artēriju trombembolijas diagnostika (D dimēri, DT angiogrāfija),
- akūtas sirds mazspējas diagnostika: BNP/NT–proBNP, ehokardiogrāfija,
- akūta koronārā sindroma un sirds aritmiju diagnostika: EKG, miokarda bojājuma marķieri. [11]
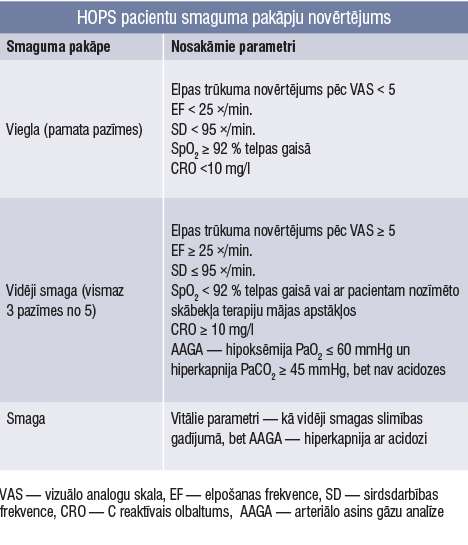

2.tabula
HOPS pacientu smaguma pakāpju novērtējums
2021. gadā Celli et al publicēja Romas kritējus, lai definētu HOPS paasinājuma smaguma pakāpi. Romas kritēriji tika izstrādāti, ekspertiem vienojoties, un iekļāva laika, klīniskās, bioloģiskās un etioloģiskās īpašības paasinājuma gadījumā (2. tabula).
ĀRSTĒŠANA
HOPS paasinājumu ārstēšanas mērķis ir mazināt pašreizējā paasinājuma negatīvo ietekmi, lai novērstu turpmāku paasinājumu attīstību.
Paasinājumu samērīgi tā smaguma pakāpei un/vai atbilstīgi pamatslimībai var ārstēt ambulatori vai stacionārā. Vairāk nekā 80 % paasinājumu tiek ārstēti ambulatori, izmantojot farmakoloģisku terapiju: bronhodilatatorus, kortikosteroīdus un antibiotikas.
Bronhodilatatori
Ātras darbības bronhodilatatori ir ļoti nozīmīgi HOPS paasinājuma ārstēšanā. Klīniskie pētījumi liecina, ka ātras darbības bēta agonistu (SABA, salbutamols) un ātras darbības antiholīnerģisko līdzekļu (SAMA, ipratropijs) efektivitāte būtiski neatšķiras. GOLD vadlīnijas iesaka paasinājumu gadījumā izmantot SAMA un SABA kombināciju, lai gan nav pārliecinošu pierādījumu, ka tā būtu pārāka par katru līdzekli atsevišķi, [19] toties ir zināmas duālās terapijas priekšrocības stabilas HOPS gadījumā. [20]
Klīniskajos pētījumos neparādās būtiskas atšķirības starp īslaicīgas darbības bronhodilatatoru, dozēto inhalatoru un nebulaizeru (inhalatoru) lietošanu. Tomēr nebulaizers vienkāršāk lietojams smagākiem pacientiem. [21] Ieteicams pacientiem neveikt nepārtrauktu izsmidzināšanu caur nebulaizeru, bet lietot 1—2 pūtienus no inhalatora ik stundu 2—3 ×, pēc tam ik pēc 2—4 stundām samērīgi atbildreakcijai. Akūta HOPS paasinājuma gadījumā nerekomendē medikamenta ievadi ar papildu skābekļa atbalstu, lai nepieaugtu PaCO2. [22]
Glikokortikoīdi
Pacientiem ar vidēji smagu vai smagu HOPS paasinājumu rekomendē sākt sistēmisko glikokortikoīdu kursu. [19] Klīniskie pētījumi liecina, ka sistēmiskie glikokortikoīdi:
- veicina ātrāku atveseļošanos un saīsina hospitalizācijas ilgumu,
- uzlabo plaušu funkciju (FEV1),
- uzlabo oksigenāciju,
- samazina paasinājuma atkārtošanās risku. [23]
HOPS paasinājuma terapijā lietotie perorālie glikokortikoīdi ātri uzsūcas (maksimālais līmenis serumā tiek sasniegts vienā stundā) un ir vienlīdz efektīvi intravenozi lietotajiem glikokortikoīdiem. [24] GOLD vadlīnijas rekomendē lietot 40 mg prednizolona (vai līdzvērtīgu glikokortikoīdu atbilstošā devā) reizi dienā piecas dienas. Ilgāks perorālo kortikosteroīdu kurss saistīts ar palielinātu pneimonijas, sepses un mirstības risku. [19]
Antibakteriālā terapija
Viegla vai vidēja HOPS paasinājuma gadījumā antibakteriālā terapija nav jānozīmē, jo tas visbiežāk ir vīrusu etioloģijas.
Antibakteriālu terapiju rekomendē sākt tiem pacientiem, kam ir trīs galvenie simptomi: izteikts elpas trūkums, palielināts krēpu daudzums un pieaug krēpu strutainība vai arī pacientam nepieciešama mehāniskā ventilācija (invazīvā vai neinvazīvā). Antibakteriālās terapijas izvēle pēc Latvijas infektologu vadlīnijām: [25]
- amoksicilīns/klavulānskābe no 625 mg līdz 1 g ik 8 h p/o,
- amoksicilīns/klavulānskābe 1,2 g ik 8 h i/v.
Alternatīva: ceftriaksons 2 g ik 24 h i/v. Ja ir alerģija pret bēta laktāmu grupas antibiotikām, tad doksiciklīns 100 mg ik 12 h p/o.
Skābekļa terapija
Papildu skābekļa atbalsts ir ļoti svarīgs akūtajā ārstēšanas posmā. Lai samazinātu hiperkapnijas risku ar pārmērīgu skābekļa pievadi, oksigenācijas mērķis SpO2 88—92 % vai arī PaO2 60— 70 mmHg. Nelielā nejaušinātā pētījumā, skābekļa atbalstu titrējot līdz SpO2 88—92 %, tika panākta mazāka mirstība salīdzinājumā ar lielākas plūsmas (bez titrēšanas) skābekļa terapiju apstākļos pirms slimnīcas. [23]
Skābekļa terapijas iespējas: [23]
- deguna kaniles var nodrošināt plūsmas ātrumu līdz 6 l/min., un ar to saistītais FiO2 ir ~ 40 %, pacientam tās ir ērtākas arī ēšanas laikā,
- mazas koncentrācijas skābekļa maska var nodrošināt FiO2 līdz 55 %, izmantojot plūsmas ātrumu 6—10 l/min.,
- jāizvairās no skābekļa terapijas ar lielas koncentrācijas masku, jo tā saistīta ar augstu hiperkapnijas risku,
- augstas plūsmas deguna kaniles nodrošina skābekļa atbalstu (regulējams FiO2 līdz 100 %) ar lielu plūsmas ātrumu (līdz 60 l/min.), kas rada zemu pastāvīga pozitīva spiediena līmeni elpceļos,
- ventilatorais atbalsts — pacientiem, kuriem atbalsta terapija ar skābekli un medikamentiem nav veiksmīga un attīstās respiratora acidoze, nepieciešams mehānisks ventilācijas atbalsts — neinvazīva vai invazīva plaušu ventilācija.
Neinvazīvā ventilācija (NIV) — neinvazīvā pozitīva spiediena ventilācija attiecas uz mehānisko ventilāciju, kas tiek veikta, izmantojot neinvazīvu pieeju caur sejas, deguna vai mutes—deguna masku. Galvenā NIV sākšanas indikācija ir akūta respiratora acidoze. Radot pozitīvu spiedienu elpceļos, tiek uzlabota oksigenācija un plaušu ventilācija, tādējādi pazeminās PaCO2 līmenis un normalizējas asins pH. NIV samazina mirstību un endotraheālas intubācijas biežumu. NIV ir izvēles ventilācijas veids daudziem pacientiem ar smagu HOPS paasinājumu. [19]
Profilaktiski pasākumi
Gripas un pneimokoku vakcinācija HOPS pacientiem ieteicama tādēļ, lai samazinātu infekciju risku. Pētījumi liecina, ka vakcinācija būtiski samazina gan infekciju biežumu, gan komplikācijas, kas saistītas ar pneimoniju. [17]
Policitēmija — sekundāra policitēmija HOPS pacientiem
Sekundāra policitēmija HOPS gadījumā sastopama bieži: 6—10,2 % ambulatoro HOPS pacientu (definēta kā hemoglobīns ≥ 17 g/dl vīriešiem, ≥ 15 g/dl sievietēm). Hroniskā hipoksēmija HOPS pacientiem stimulē eritropoetīna sintēzi nierēs, kas veicina sarkano asins šūnu (eritrocītu) produkcijas pieaugumu, lai kompensētu skābekļa trūkumu audos. [26] Eritrocītu masas palielināšanās palielinātu trombozes risku un komplikācijas sirds—asinsvadu sistēmā. [27]
HOPS pacientiem skābekļa transportēšanas mehānismi ir bojāti, tāpēc rodas hroniska hipoksēmija " tā izraisa pastāvīgu eritropoetīna sintēzi, kas stimulē eritrocītu veidošanos. Laika gaitā eritrocītu pieauguma dēļ paaugstinās hematokrīta līmenis un palielinās asins viskozitāte " pasliktinās asinsrite un pieaug risks asinsvadu slimību attīstībai. [28]
Klīniskās izpausmes un sekas
Sekundāra policitēmija HOPS pacientiem bieži saistīta ar palielinātu nogurumu, elpas trūkumu un galvassāpēm, jo paaugstināts hematokrīta līmenis un palielināta asins viskozitāte apgrūtina asinsriti. [29]
Sekundāra policitēmija saistīta arī ar palielinātu trombozes un embolijas risku, kas var būt bīstams, it īpaši kombinācijā ar citām HOPS komplikācijām, piemēram, plaušu hipertensiju. [30] Pētnieki norāda, ka īpaši izteiktas šīs sekas ir pacientiem ar smagu HOPS, kuriem ir ļoti paaugstināts sarkano asins šūnu līmenis. [31]
Diagnostika
- Pilna asins aina. Palielināts eritrocītu skaits un paaugstināts hematokrīta līmenis (virs 55 %) ir galvenie rādītāji sekundārai policitēmijai. HOPS pacientiem ar sekundāru policitēmiju bieži novēro paaugstinātu hemoglobīna līmeni. [27]
- Eritropoetīna līmeņa noteikšana. Paaugstināts eritropoetīna līmenis asinīs liecina par hipoksēmiju kā sekundāras policitēmijas cēloni. Šo analīzi var veikt, lai novērtētu eritropoetīna reakciju uz hipoksiju. [32]
Ārstēšana un vadlīnijas
- Skābekļa terapija. HOPS pacientiem ar sekundāru policitēmiju nozīmīga ir terapija ar skābekli, lai mazinātu hipoksēmiju un samazinātu eritropoetīna sintēzi. Skābekļa terapija ir efektīva, lai uzlabotu audu oksigenāciju, un tiek uzskatīta par vienu no galvenajām ārstēšanas metodēm šiem pacientiem. [33]
- Asins atšķaidīšanas terapija. Asins viskozitātes samazināšana ir vēl viens būtisks ārstēšanas mērķis. Dažkārt tiek veikta flebotomija, lai samazinātu asins viskozitāti un mazinātu komplikāciju risku. [34] Šāda terapija īpaši der pacientiem ar palielinātu trombozes risku.
KOPSAVILKUMS
- Aptuveni 10 % indivīdu, kas vecāki par 40 gadiem, ir diagnosticēta HOPS.
- HOPS izraisa ievērojamu veselības aprūpes resursu patēriņu, biežas vizītes pie ārstiem, atkārtotu hospitalizāciju akūtu paasinājumu dēļ un nepieciešamību pēc ilgstošas terapijas.
- Rakstā apskatītas tādas HOPS komplikācijas kā akūts slimības paasinājums un policitēmija.
- Nākamajā Doctus numurā lasiet par hronisku elpošanas mazspēju un plaušu hipertensiju.