Žurnālam Doctus bija iespēja piedalīties 17. Eiropas Hematologu asociācijas rīkotajā kongresā Amsterdamā, kurā īpaša darba sesija bija veltīta multiplās mielomas ārstēšanas iespējām. Esam apkopojuši nozīmīgāko pētījumu rezultātus. Mieloma ir otrais biežākais asins ļaundabīgais audzējs aiz limfomas, proti, apmēram 1% no visiem ļaundabīgajiem audzējiem. ASV un lielākajā daļā Rietumeiropas valstu mielomas incidence ir 3–4 gadījumi uz 100 000 iedzīvotāju. Latvijā 2011. gadā tika reģistrēti 102 pacienti ar multiplo mielomu, tas ir, 5 gadījumi uz 100 000 iedzīvotāju. Piecu gadu izdzīvotība ir 10–50%, tomēr ar jaunajiem ārstēšanas režīmiem pacienti dzīvo 10–20 vai pat vairāk gadus. Mieloma nav izārstējama, bet labi padodas ārstēšanai, Amerikas Savienotajās Valstīs tiek ordinēti vairāk nekā 100 medikamentu režīmi.


Simpozijs par multiplas mielomas ārstēšanas iespējām
Vecie un jaunie medikamenti nesen diagnosticētas multiplās mielomas pacientiem
Divas trešdaļas pirmreizēji diagnosticētu multiplās mielomas pacientu ir vecāki par 65 gadiem un/vai viņu fiziskais stāvoklis neļauj viņiem ordinēt lielu devu ķīmijterapiju un cilmes šūnu transplantāciju. Ārstēšanas mērķis šādiem pacientiem ir pagarināt izdzīvotību, sasniedzot labāko iespējamo atbildes reakciju ar pieejamajiem medikamentiem, nepasliktinot dzīves kvalitāti.
Līdz šim ārstēšanas iespējas šādiem pacientiem bija ierobežotas, bet tagad, kad ir kombinācijas ar jaunajiem medikamentiem – talidomīdu, bortezomibu, lenalidomīdu un bendamustīnu –, iespējams ievērojami uzlabot pacientu stāvokli. III fāzes pētījumu rezultāti pierāda arī to, ka uzturošā terapija vai ilgstoša ārstēšanas gados veciem cilvēkiem uzlabo dzīves kvalitāti un pagarina klīnisko efektu ilgumu, pagarinot gan laiku līdz slimības progresijai, gan pagarinot izdzīvotības laiku bez progresijas, tomēr vēl nav definētas optimālās medikamentu shēmas, piemērotākās devas un lietošanas ilgums. Vēl nepieciešami arī pētījumi par jauno medikamentu drošuma profilu.
Jāatceras, ka ar jaunajiem medikamentiem iespējams pagarināt pacientu izdzīvotību, tomēr nedrīkst aizmirst par pacienta novērošanu, devas individuālu piemērošanu, lai uzlabotu panesamību un ārstēšanas efektivitāti, kā arī nedrīkst aizmirst par pacienta dzīves kvalitātes saglabāšanu.
Mateos MV, San Miguel JF. Old and new treatments in non-transplant candidate newly diagnosed multiple myeloma patients. Hematology Education: the education programme for the annual congress of the European Hematology Association, 2012; 6(1): 221.
Uzturošā terapija ar lenalidomīdu statistiski ticami samazina progresijas risku pacientiem ar nesen diagnosticētu multiplo mielomu
Lielu devu ķīmijterapija un autologo cilmes šūnu transplantācija (ASCT) ir standarta ārstēšanas metode pacientiem ar multiplo mielomu (MM), kuri jaunāki par 65 gadiem. Jaunu medikamentu iekļaušana uzturošās terapijas shēmās maina ārstēšanas paradigmas.
Pētījuma mērķis bija salīdzināt parasto ķīmijterapiju plus jauno medikamentu (melfalans–prednizolons plus lenalidomīds) ar lielas devu melfalānu (melfalāns 200 mg/m2 (MEL200) plus cilmes šūnu transplantācija), kam sekoja uzturoša terapija ar lenalidomīdu vai uzturošā terapija nesekoja.
Metodes
Tas bija perspektīvs, nejaušināta iedalījuma pētījums (MM–RV–PI209) par 402 pacientiem, kas saņēma sākotnējo terapiju ar lenalidomīdu (25 mg, 1.–21. diena) četros 28 dienu ciklos kombinācijā ar mazu devu deksametazonu (40 mg, 1., 8., 15., 22. dienā). Pēc sākotnējās terapijas nejaušināti atlasīja 202 pacientus un ārstēja ar MPR (seši 28 dienu cikli ar melfalānu (0,18 mg/kg 1.–4. dienā), prednizolonu (2mg/kg 1.–4.dienā) un lenalidomīdu (10 mg 1.–21. dienā)), tad daļai pacientu sekoja uzturošā terapija ar lenalidomīdu (10 mg, 1.–21.dienā; n=98), bet daļa pacientu (n=104) uzturošo terapiju nesaņēma. Pārējie 200 pacienti saņēma MEL200, tad 100 pacientiem sekoja uzturošā terapija ar lenalidomīdu (10 mg 1.–21.dienā; n=100) vai uzturošā terapija netika nozīmēta (n=100). Galvenais pētījuma iznākums bija izdzīvotība bez slimības progresēšanas (progression-free survival – PFS).
Rezultāti
Vidējais pacientu vecums bija 58 gadi abās grupās. Atbildes reakcija bija līdzīga abās grupās (MPR pret MEL200) ar ļoti labu daļēju atbildes reakciju (VGPR) 60% pret 58% (p=0,24) un pilnīgu atbildes reakciju 20% pret 25% (p=0,49). Pēc 33 mēnešu novērošanas perioda 3 gadu PFS bija 38% MPR grupā un 59% MEL200 grupā (HR=0,6; p<0,001). Kopējā trīs gadu izdzīvotība bija līdzīga: 82% MPR grupā un 85% MEL200 grupā (HR=0,87; p=0,57). Vidējais uzturošās terapijas laiks bija 18,4 mēneši. Uzturošā terapija ar lenalidomīdu statistiski ticami neuzlaboja atbildes reakciju, pilnīga atbildes reakcija bija 20% pēc MPR un 22% pēc uzturošās terapijas, salīdzinājumam – pēc MEL200 pilnīga atbildes reakcija bija 25% un pēc uzturošās terapijas 30%. Divu gadu PFS no uzturošās terapijas sākuma bija 66% pacientu, kas saņēma uzturošo terapiju un 47% pacientu bez uzturošās terapijas. Uzturošā terapija ar lenalidomīdu samazināja slimības progresēšanas risku par 46% (HR=0,54; p=0,002; skat. attēlu). Divu gadu novērotā dzīvildze bija līdzīga: 88% pacientu ar uzturošo terapiju ar lenalidomīdu un 85% pacientu bez uzturošās terapijas (HR=0,71; p=0,28). Pacientiem, kas 2 gadus uzturošajā terapijā saņēma MPR plus lenalidomīdu, PFS bija līdzīga ar tiem pacietiem, kas saņēma MEL200 bez uzturošās terapijas (attiecīgi 59% un 63%). Sekundāru primāru malignitāšu biežums bija 2% abās grupās.
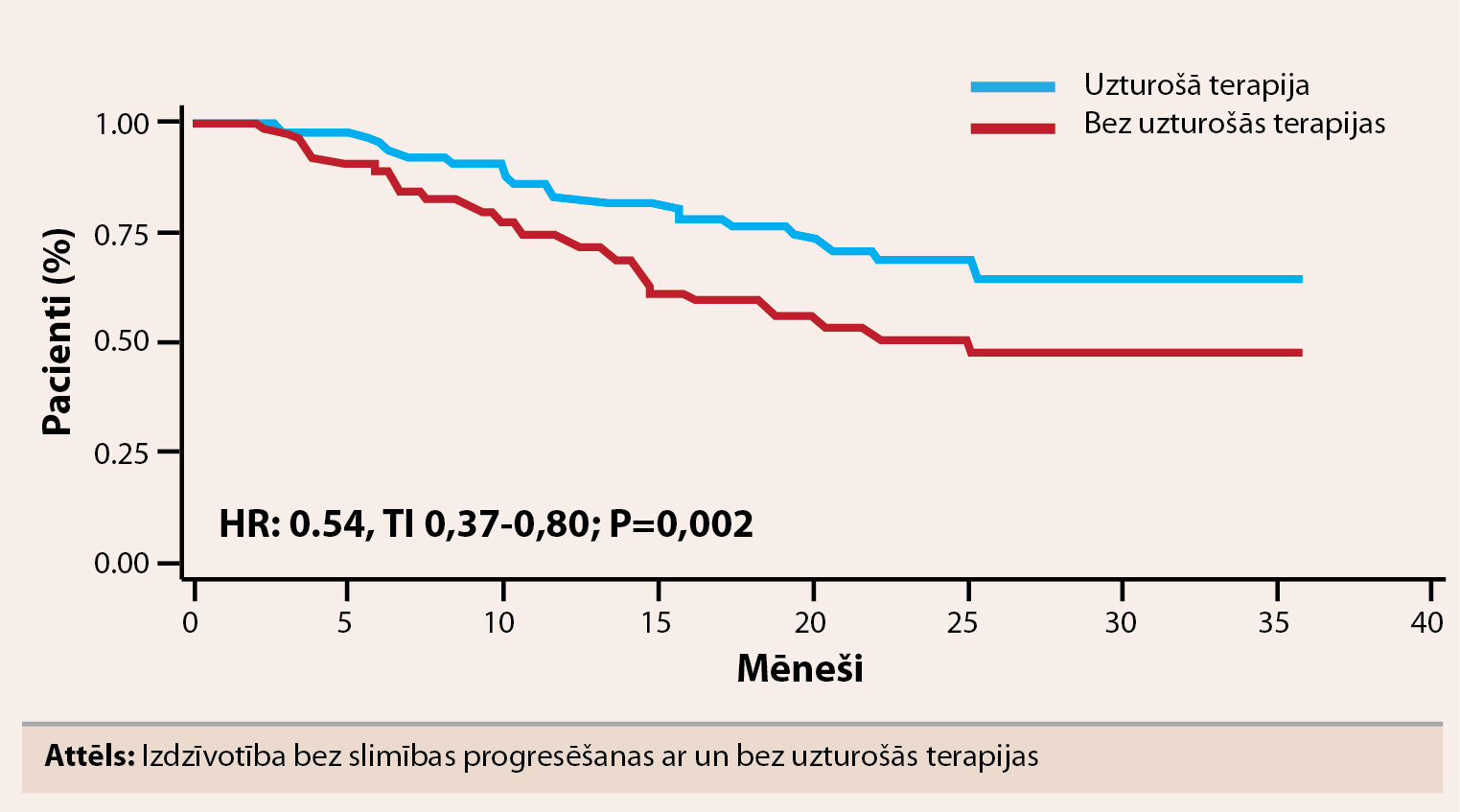

Attels
Izdzīvotība bez slimības progresēšanas ar un bez uzturošās terapijas
Secinājums
Uzturošā terapija ar lenalidomīdu statistiski ticami mazina slimības progresēšanas risku nesen diagnosticētiem pacientiem ar multiplo mielomu. PFS pacientiem, kas ārstēšanā saņēma MPR plus uzturošo terapiju, bija līdzvērtīga ar MEL200 terapiju bez uzturošās terapijas.
Cavallo F, Hardan I, Gay F,et al. Lenalidomide maintenance significantly reduce the risk of progression in newly diagnosed young multiple myeloma patients enrolled in RV-MM-PI-209 trial. Haematologica, 2012; Vol 97, e-Supplement 1, June 14-17: 552.
Proteasomu inhibitors (MLN9708) kombinācijā ar lenalidomīdu un deksametazonu pacientiem ar iepriekš neārstētu multiplo mielomu
MLN9708 ir perorāls, atgriezenisks un specifisks 20S proteasomu inhibitors, kas šobrīd ir klīniskās izpētes procesā un, iespējams, ir efektīvs vairākiem audzēju tipiem, arī neārstētas multiplās mielomas gadījumos (MM). Pētījuma mērķis bija noskaidrot iespējas un efektivitāti, apvienojot proteasomu inhibitorus ar imūnmodelējošiem medikamentiem pacietiem ar iepriekš neārstētu multiplo mielomu.
Metodes
Pacienti vecāki par 18 gadiem ar iepriekš neārstētu multiplo mielomu saņēma perorālo MNL9708 vienu vai divas reizes nedēļā. Ārstēšanas režīms vienu reizi nedēļā: MLN9708 1., 8. un 15. dienā, lenalidomīds 25 mg 1.–21. dienā un deksametazons 40 mg 1., 8., 15. un 22.dienā 28 dienu ciklā. Ārstēšanas režīms divas reizes nedēļā: MLN9708 1., 4., 8. un 11. dienā, lenalidomīds 25 mg 1.–14.dienā un deksametazons 20/10 mg (cikls 1.–8./cikls 9.–16.) 1., 2., 4., 5., 8., 9., 11. un 12. dienā 21 dienas ciklā. Devas eskalāciju turpināja, izmantojot standarta shēmu 3+3 pēc devas limitētas toksicitātes 1. ciklā. Tika analizētas blakusparādības, tāpat atbildes reakcija uz ārstēšanu tika novērtēta ar IMWG kritēriju, arī nCr.
Rezultāti
2012. gada 27. janvārī 51 pacients (vidējais vecums 65 gadi (38–86)) saņēma MNL9708 vienu reizi nedēļā (15 pacienti I fāzē, 1,68–3,95 mg/m2; 36 pacienti II fāzē, 4 mg fiksēta deva) un 6 pacienti (vidējais vecums 64 gadi (56–78)) saņēma MLN9708 divas reizes nedēļā (visi pacienti I fāzē; 4 pacienti saņēma 3 mg, 2 pacienti – 3,7 mg). Starp pacientiem, kas zāles saņēma vienu reizi nedēļā, I fāzē pacienti saņēma 6 ciklus (1–13 cikli) un II fāzē – 2 ciklus (1–4 cikli). Pacienti, ko ārstēja divas reizes nedēļā, saņēma 2,5 ciklus (1–3 cikli). 39 pacienti ar ārstēšanu 1 reizi nedēļā un visi 6 pacienti ar ārstēšanu divas reizes nedēļā turpina ārstēšanos. 6 pacienti no tiem, ko ārstēja vienu reizi nedēļā, blakusparādību dēļ ārstēšanos pārtrauca. Medikamenta drošuma dati apkopoti tabulā. Medikamentu izraisīta toksicitāte, kas tika novērtēta ar 3 vai vairāk, bija atgriezeniska, pārsvarā tā bija caureja, eritematozi izsitumi, sinkope un vemšana pacientiem, kas zāles saņēma vienu reizi nedēļā (n=2 katrai blakusparādībai) un hiperglikēmija tiem, kas zāles saņēma divas reizes nedēļā (n=1). Ar medikamentiem saistīta perifēra neiropātija tika novērota 7 pacientiem no tiem, ko ārstēja vienu reizi nedēļā, un vienam pacientam no tiem, ko ārstēja 2 reizes nedēļā.
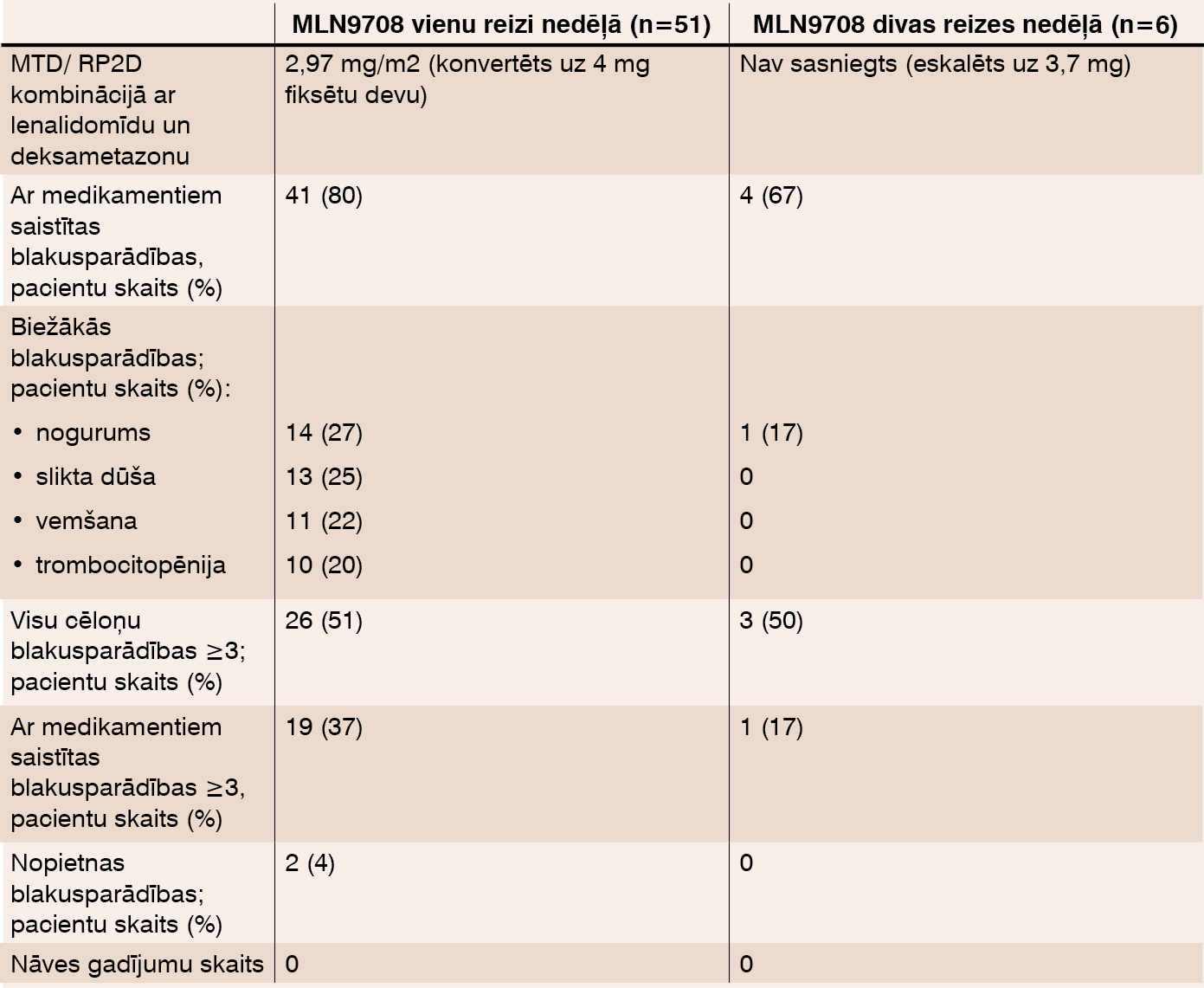

Tabula
Medikamentu drošuma profils
Secinājumi
Pētījuma rezultāti apstiprina, ka MLN9708 perorāla lietošana vienu vai divas reizes nedēļā kombinācijā ar lenalidomīdu un deksametazonu ir labi panesama ar pārvaldāmu toksicitāti un rāda anti-audzēja aktivitāti pacientiem ar neārstētu multiplo mielomu.
Richardson P, Berdeja J, Niesvizky R, et al. MLN9708, an investigational proteasome inhibitor, combined with lenalidomide and dexamethasone in previously untreated multipla myeloma patients: evaluation of weekly and twice-weekly dosing regimens. Haematologica, 2012; Vol 97, e-Supplement 1, June 14-17: 553-554.
Elotuzumabs ar lenalidomīdu un mazu devu deksametazonu pacientiem ar refraktoru multiplo mielomu
Elotuzumabs ir cilvēka monoklanārā IgG1 antiviela, kas iedarbojas uz CS1, proti, šūnas virsmas glikoproteīnu. CS1 ir vairāk nekā 95% multiplās mielomas pacientu šūnās. I fāzes pētījumā elotuzumabs plus lenolidomīds un mazu devu deksametazons uzrādīja 82% atbildes reakciju pacientiem ar refraktoru multiplo mielomu. Šā pētījuma mērķis bija novērtēt drošumu un efektivitāti, lietojot elotuzumabu kombinācijā ar lenalidomīdu un mazu devu deksametazonu pacientiem ar refraktoru multiplo mielomu, tostarp pacientiem ar augsta riska slimību.
Metode
Šajā II fāzes pētījumā nejaušināti tika izvēlēti iepriekš ārstēti pacienti. Šajā pētījumā pacienti tika ārstēti ar elotuzumabu 10 vai 20 mg/kg intravenozi (1., 8., 15. un 22. dienā ik 28 dienu pirmajos divos ciklos un 1. un 15. dienā nākamajos ciklos), lenalidomīdu 25 mg perorāli (1.–21.dienā) un deksametazonu 40 mg perorāli vienu reizi nedēļā. Pirms katras elotuzumaba infūzijas tika veikti profilakses pasākumi, lai izvairītos no ar infūzijām saistītām blakusparādībām. Ārstēšana tika turpināta līdz brīdim, kad slimība progresēja vai parādījās nepieņemama toksicitāte.
Rezultāti
No 73 pacientiem (vidējais vecums 63 gadi (39–81 gadi) 55% iepriekš bija saņēmuši 2 vai vairāk medikamentus, 60% bija iepriekš lietojuši bortezomibu, bet 62% – talidomīdu. Objektīva atbildes reakcija bija 82% pacientu, no tiem 48% vai vairāk bija ļoti laba daļēja atbildes reakcija. Objektīva atbildes reakcija bija 92% pacientu, kas saņēma elotuzumabu 10 mg/kg (n=36), un 73% tiem, kas saņēma elotuzumabu 20 mg/kg (n=37). Vidējais laiks līdz objektīvai atbildei bija 1 mēnesis (0,7–5,8). Pēc vidējā novērošanas laika 14,1 mēnesis, vidējā izdzīvotība bez progresēšanas (PFS) bija 75% (10 mg/kg grupā) un 65% (20 mg/kg grupā). Objektīvā atbildes reakcija bija 80% pacientu ar augsta riska citoģenētiku un 81% pacientu ar 2.–3. stadijas multiplo mielomu. Biežākās blakusparādības bija neitropēnija (16%), limfopēnija (16%) un trombocitopēnija (16%).
Secinājumi
Elotuzumabs kombinācijā ar lenalidomīdu un mazu devu deksametazonu kopumā ir labi panesams un rezultējas ar augstu objektīvās atbildes reakciju, PFS netiek sasniegta pēc 14,1 mēneša novērošanas pacientiem ar refraktoru multiplo mielomu. Šī kombinācija uzrādīja efektivitāti arī pacientiem ar augsta riska citoģenētiku un/vai 2.–3. stadijas multiplo mielomu. Šobrīd turpinās vēl divi III fāzes pētījumi par elotuzamabu 10 mg/kg kombinācijā ar lenalidomīdu un mazu devu deksametazonu pirmreizēji diagnosticētiem multiplās mielomas pacientiem un pacientiem ar refraktoru mielomu.
Moreau P, Richardson P, Jagannath S, et al. A randomized phase 2 study of elotuzumab with lenalidomide and low-dose dexamethasone in patients with relapsed/ refractory multiple myeloma. Haematologica, 2012; Vol 97, e-Supplement 1, June 14-17: 554.
Faktori, kas ietekmē mielomas pacientu izdzīvotību, lietojot jaunākos medikamentus
Multiplā mieloma ir biežākais hematoloģiskais audzējs vecu cilvēku populācijā. Vidējais vecums diagnozes noteikšanas brīdī ir 70 gadi; 37% pacientu ir vecāki par 75 gadiem, 30% pacientu ir vismaz viena blakus saslimšana. Jauno medikamentu (bortezomiba, talidomīda un lenalidomīda) ienākšana klīniskajā prakse mainījusi ārstēšanas paradigmas gados veciem pacientiem ar multiplo mielomu, tiesa, tagad blakusparādības ir biežāk un pilnas devas medikamenti ir sliktāk panesami. Ir ziņojumi, ka 90% pacientu bijusi vismaz viena nopietna blakusparādība un 40% pacientu pārtraukuši medikamentu lietošanu. Šā pētījuma mērķis bija novērtēt 1435 pacientu datus no četriem Eiropas III fāzes pētījumiem. Tika analizēta vecuma un orgānu bojājuma ietekme uz blakusparādībām, kas saistītas ar ārstēšanu, un medikamentu lietošanas pārtraukšanu.
Metodes
Pētījumā iekļauti pacienti ar nesen diagnosticētu multiplo mielomu, kuriem nevar veikt autologo transplantāciju vecuma vai blakus saslimšanu dēļ, kuri terapijā saņēma melfalanu–prednizonu (MP), MP–talidomīdu (MPT), MP–bortezomibu (VMP), bortezomibu–talidomīdu–prednizonu (VTP) vai VMP–talidomīdu (VMPT). Meta-analīzē tika iekļauti 4 pētījumi.
Rezultāti
No 1435 analizētajiem pacientiem 332 pacienti nelietoja jaunos medikamentus (MP), 332 lietoja talidomīdu (MPT), 387 bortezomibu (VMP), 384 talidomīdu un bortezomibu (VTP/VMPT). 36% pacientu bija vismaz 75 gadus veci. Pacientu proporcija ar ISS III bija mazāka MP grupā; nieru mazspēja biežāk bija MP un MPT grupā. Ne-hematoloģiskas blakusparādības tika novērotas 29% pacientu, ar lielāku proporciju MPT grupā (43%), salīdzinot ar VMP (24%) vai VTP/VMPT (32%) grupu. Biežākās blakusparādības bija infekcijas (10%), perifēra neiropātija (8%), sirds (6%) un gremošanas trakta komplikācijas (5%). Medikamentu lietošanas pārtraukšana toksicitātes dēļ bija 27%, lielāka proporcija bija MPT grupā (35%), salīdzinot ar VMP (16%) vai VTP/VMPT grupu (29%). Pēc vidējās novērošanas 33 mēnešiem (95% TI [10–56]), 513/1435 pacienti (36%) nomira, vidējā kopējā izdzīvotība bija 50 mēneši (95% TI [46–69]). Nāves cēlonis 76% pacientu bija slimības progresēšana, bet 24% toksiska iedarbība, galvenokārt infekcijas, sirds komplikācijas, otrs primāras lokalizācijas audzējs un vēnu trombembolisms. Mirstības riska līmenis bija augstāks pacientiem, kas bija vecāki par 75 gadiem (HR=1,44; 95% TI [1,20–1,72]; p<0,001), pacientiem ar nieru mazspēju (HR=2,02; 95% TI [1,51–2,70]; p<0,001), kā arī pacientiem ar 3.–4. pakāpes sirds, infekciju vai gremošanas trakta blakusparādībām ārstēšanas laikā (HR=2,53; 95% TI [1,75–3,64]; p<0,001). Mirstības riska līmenis ir paaugstināts arī pacientiem, ko ārstēja kompleksi.
Secinājumi
Vecums virs 75 gadiem un/vai nieru mazspēja, kā arī sirds, gremošanas trakta un infekciju blakusparādības negatīvi ietekmē pacientu izdzīvotību.
Gados veciem pacientiem ar multiplo mielomu iesaka novērtēt orgānu funkcijas un izvēlēties mazāk intensīvu personalizēto terapiju, kā arī uzlabot panesamību un optimizēt iedarbīgumu.
Larocca A, Bringhen S, Mateos MV, et al. Advanced age, organ damage and adverse events negatively affect survival of myeloma patients receiving novel agents: a meta-analysis of 1435 individual patient data from 4 randomized clinical trials. Haematologica, 2012; Vol 97, e-Supplement 1, June 14-17, 132.