Pretvīrusu imunitāti nodrošina nespecifiskās un specifiskās – šūnu un humorālās – imūnsistēmas harmoniska kopdarbība. Rakstā aplūkoti humorālās un šūnu imunitātes veidošanās mehānismi atbildē pret vīrusu infekciju organismā, ieskicējot mūsdienās aktuālu vīrusu (B hepatīta, gripas u. c.) un organisma savstarpējās iedarbības modeļus.
Vīrusi spēj replicēties tikai šūnā, izmantojot tās nukleīnskābju un proteīnu sintēzes mehānismus, jo pašiem tādu nav. Vīrusa dzīves ciklā izšķir ekstracelulāro (pirms šūnas inficēšanas un pēc iziešanas no šūnas) un intracelulāro periodu (kura laikā notiek tā vairošanās).
Nedaudz par vīrusu darbības īpatnībām šūnā.
- Pēc piestiprināšanās pie saimnieka šūnas virsmas specifiskā receptora, ieiešanas šūnā un izģērbšanās daudzu vīrusu replikācija izraisa nopietnu saimnieka šūnas bojājumu (citopātisku efektu) ar sekojošu citolīzi. Šādus vīrusus sauc par citopātiskiem vīrusiem, piemēram, gripas, paragripas, respiratori sincitiālais vīruss (RSV), masalu, rino-, polio-, epidēmiskā parotīta, entero-, Rota, Herpes simplex (HSV), Epšteina-Barra (EBV), baku vīruss u.c. Šūnu bojājumu izraisa paša saimnieka citotoksiskie T limfocīti (TC), kas nogalina inficētās šūnas tad, kad uz to virsmas parādās (ekspresējas) vīrusu antigēni.
- Citi vīrusi neizraisa tūlītēju tiešu šūnas bojājumu - vīrusa nukleīnskābe persistē šūnā, sintezējas vīrusu proteīni, attīstās latenta subklīniska infekcija. Šādus vīrusus dēvē par necitopātiskiem vīrusiem. Piemēri: hepatīta B vīruss (HBV), hepatīta C vīruss (HCV), cilvēka imūndeficīta vīruss (HIV).
Vīrusa un organisma mijiedarbība - imūnatbildes dalībnieki un mehānismi
Nespecifiskā imūnā atbilde
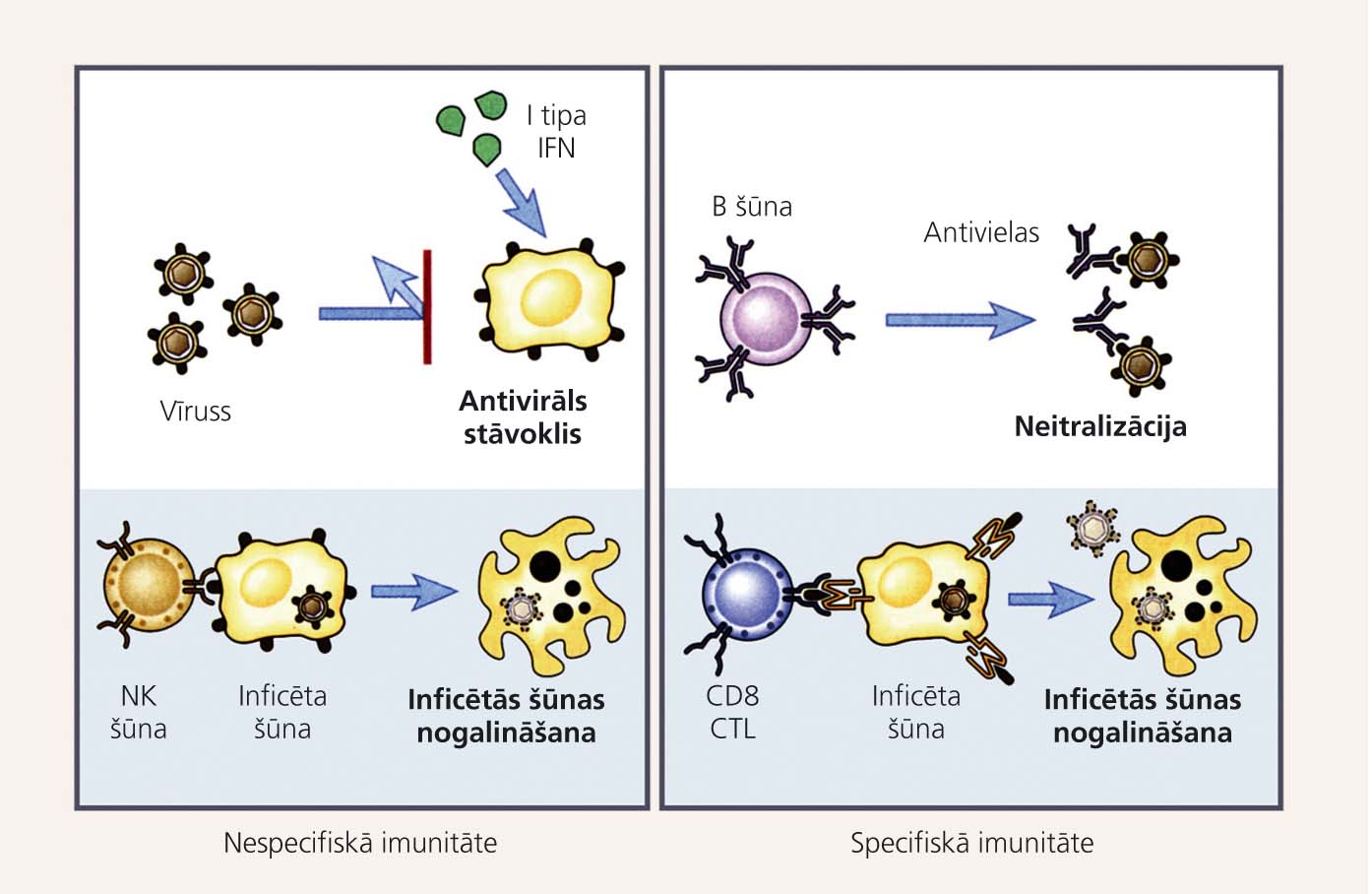
Kā jau minēts, pretvīrusu imunitāti nodrošina šūnu un humorālās imūnsistēmas kopdarbība (1. attēls).

1. attēls
Imūnās atbildes reakcijas pret vīrusu infekciju
Nespecifiskās imūnās atbildes reakcijas pret vīrusu infekciju nodrošina:
- pirmā tipa interferoni (alfa IFN un beta IFN) - tā dēvētā dabīgā pretvīrusu antibiotika, kas kavē vīrusu replikāciju inficētajās šūnās un inducē rezistenci pret inficēšanos neinficētajās šūnās (antiviral state);
- naturālie killeri (natural killer cells - NK), kas nogalē ar vīrusiem inficētās šūnas.
Abi šie faktori nodrošina ļoti svarīgu nespecifisku antivirusālu imunitāti agrīnā vīrusu infekcijas stadijā, kad adaptīvās imunitātes mehānismi vēl nav ieslēgušies. Daudzu vīrusu replikācija ir saistīta ar divdiegu RNS sintēzi - tā caur TLR3 receptoriem stimulē pirmā tipa interferonu produkciju, kuri šūnās inducē antiviral state - antivirālu stāvokli. Respektīvi interferoni ir glikoproteīdi, ko kā atbildi uz vīrusu infekciju un citiem interferonogēniem ražo inficētās šūnas. IFN piestiprinās apkārtējo šūnu interferona receptoriem un inducē tajās nespecifisku antivirusālu rezistenci, t. i., pasargā tās no virusālām infekcijām. Izšķir:
- leikocitāro; alfa interferonu (alfa IFN);
- fibroblastu; beta interferonu (beta IFN);
- imūno jeb gamma interferonu (gamma IFN), ko ražo T limfocīti un kas ir arī jaudīgs imūnmodulators.
Naturālie killeri nogalē ar vīrusiem inficētās šūnas (arī tās, uz kuru virsmas vīrusi ir izslēguši MHC (galvenā audu saderības faktora) I klases molekulu ekspresiju - MHC I molekulu neesamība uz šūnu virsmas ir signāls NK nogalēt tādas šūnas. Uz pašu NK virsmas nav MHC antigēnu, un šīs šūnas nesadarbojas ar T helperiem.
Specifiskā imūnā atbilde
Specifiskās jeb adaptīvās imūnās atbildreakcijas pret vīrusu infekciju realizē:
- imūnglobulīni (Ig), kas kavē vīrusu piesaistīšanos saimnieka šūnas virsmas specifiskajam receptoram un ieiešanu tajā (vīrusu neitralizācijas reakcija);
- citotoksiskie T limfocīti (T killeri, CTL, TC jeb CD8), kas nogalē ar vīrusiem inficētās šūnas.
Imūnglobulīni (Ig) uz vīrusiem iedarbojas tikai ekstracelulārajās vīrusu infekcijas stadijās, t. i., pirms vīrusa ieiešanas šūnā vai pēc iziešanas no tās, un darbojas galvenokārt kā vīrusus neitralizējošas antivielas, kas piesaistās vīrusu virsmas antigēniem un kavē to piesaistīšanos saimnieka šūnas virsmas specifiskajam receptoram un ieiešanu mērķšūnā. IgA aizsargā elpceļu un kuņģa-zarnu trakta gļotādas no vīrusu invāzijas. Specifiskie Ig var arī opsonizēt vīrusu daļiņas, sagatavot un veicināt to fagocitozi, kā arī aktivēt komplementa sistēmu, kas tās sagremo.
Aizsardzība pret vīrusu infekcijām ir svarīgākā citotoksisko T limfocītu funkcija. Uz visu kodolu saturošo šūnu virsmas ir ekspresētas MHC I klases molekulas, kuru nepārtrauktu pārraudzīšanu (monitoring) veic citotoksiskie T limfocīti. TC pazīst vīrusu antigēnus saistībā ar MHC I klases molekulām uz ar vīrusiem inficēto šūnu virsmas un nogalē inficētās šūnas. Ar vīrusiem inficēto šūnu labāku pazīšanu veicina TC sadarbība ar TH (CD4) un profesionālām antigēnprezentējošām šūnām (makrofāgiem, folikulārajām dendrītiskajām, sapirkstotajām un Langerhansa šūnām).
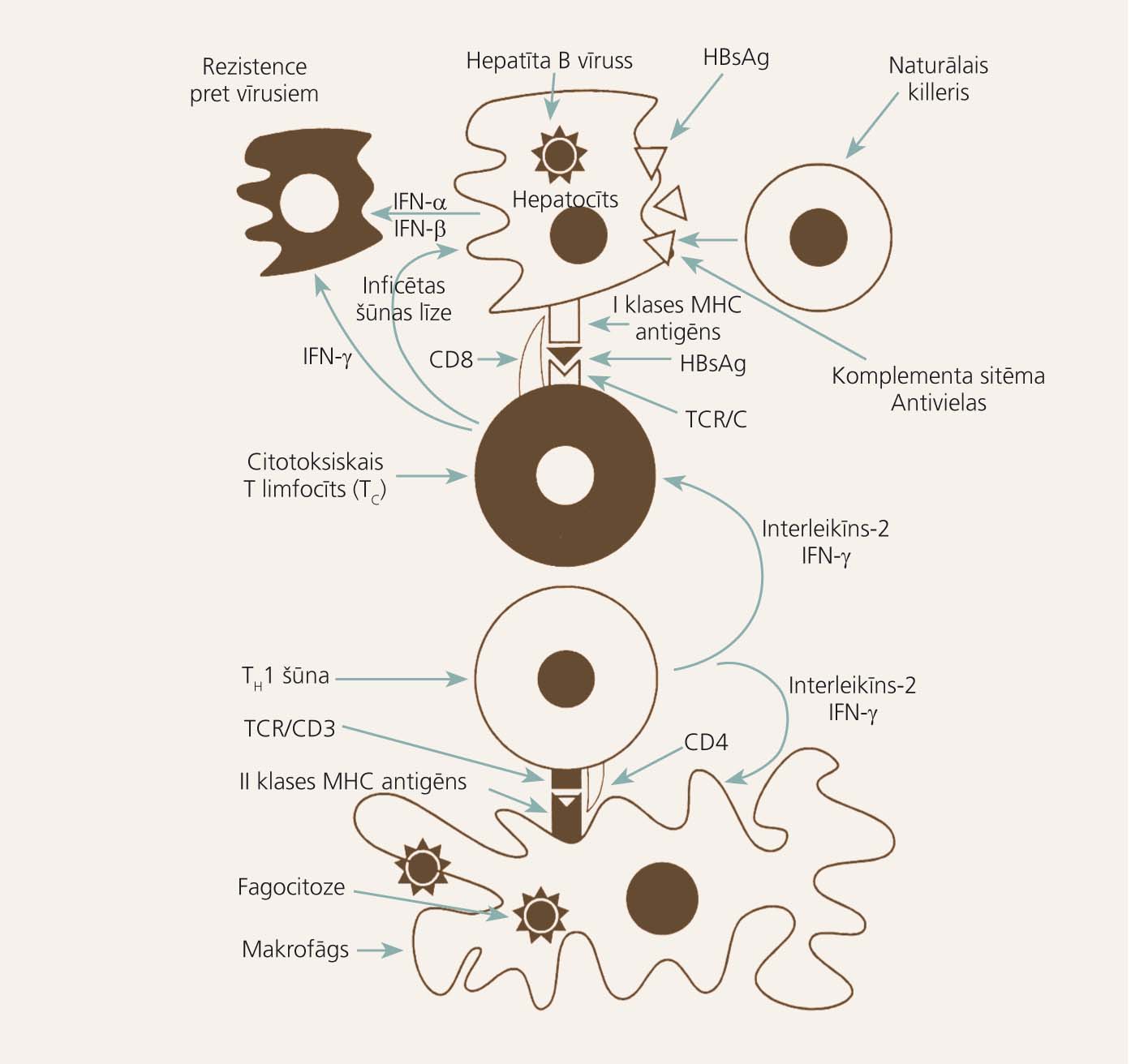
Dažkārt TC, īpaši infekciju gadījumā ar necitopātiskiem vīrusiem, piemēram, hepatīta B vīrusiem vai limfocitārā horiomeningīta vīrusiem, izraisa imunoloģiski pastarpinātu audu bojājumu - hepatītu vai meningītu. Jo personas šūnu imūnatbildes reakcija būs spēcīgāka (jauna, vesela imūnkompetenta persona), jo smagāks būs audu bojājums un smagāka slimības (piemēram, hepatīta B vai meningīta) norise. Ja personas šūnu imūnatbildes reakcija būs vāja (piemēram, gados vecs, novājināts cilvēks, kas slimo ar alkoholismu, tuberkulozi vai cukura diabētu), audu bojājums būs maigāks un slimības norise vieglāka. Šādam pacientam klīniski manifests ikterisks hepatīts B vai meningīts visticamāk neattīstīsies, bet infekcijas process norisināsies subklīniski, latenti, kā tā dēvētā HBsAg nēsāšana (2. attēls).

2. attēls
Šūnu un humorālās imūnatbildes reakcijas hepatīta B vīrusu infekcijas gadījumā
Atkāpei - daži vārdi par hepatītu izraisošiem vīrusiem. HBs Ag - hepatīta B vīrusa virsmas (surface) antigēnu, ko agrāk dēvēja par Austrālijas antigēnu, Austrālijas aborigēna serumā 1964. gadā atklāja ASV zinātnieks B. Blumbergs. Vēlāk noskaidrojās, ka Austrālijas antigēns ir atrodams ar HBV inficētu personu asinīs un tas ir vērtīgs HBV infekcijas diagnostiskais marķieris. Tīrs HBs Ag, ko iegūst ar gēnu inženierijas tehnoloģiju (rekombinantais HBs Ag), ir ļoti efektīva vakcīna hepatīta B profilaksei, ko tagad lieto visā pasaulē. B. Blumbergam par HBs Ag atklāšanu, tā būtības noskaidrošanu un hepatīta B rekombinantās vakcīnas radīšanu 1983. gadā piešķīra Nobela prēmiju medicīnā. Austrālijas antigēna atklāšana stimulēja ne tikai Dane daļiņas, t. i., hepatīta B vīrusa, atklāšanu jau 1965. gadā, bet arī HAV izolēšanu 1973. gadā.
Mārio Ricetti 1977. gadā atklāja HBV satelītvīrusu - hepatīta D vīrusu (HDV jeb delta antigēnu), bet Čū, Kū un Veiners 1989. gadā - hepatīta C vīrusu (HCV). To paveica ļoti neparasti, pirmo reizi izmantojot aklo klonēšanu (blinde cloning) ar nesen Berklijas universitātē Kerija Mullis radīto polimerāzes ķēdes reakciju (PĶR), kas ir neparasti specifisks un jutīgs tests un ko tagad ļoti plaši lieto molekulārajā bioloģijā, medicīnā un kriminālistikā.
T helperi
Uz T helperu (T līdzētājšūnu) virsmas ir CD4 receptori, bet uz T citotoksisko limfocītu (TC) virsmas - CD8 receptori.
- TH1 šūnas (pirmā tipa T helperi jeb pirmā tipa CD4) ir T helperu subpopulācija, kas secernē interleikīnu-2 (IL-2) un gamma interferonu (gamma IFN). Pirmā tipa CD4, CD8 un makrofāgu kopdarbība nodrošina šūnu imunitātes attīstību.
- TH2 (otrā tipa CD4) ir T helperu subpopulācija, kas secernē interleikīnu-4 (IL-4), IL-5, IL-6 un IL-10. TH2 limfocīti stimulē B limfocītu proliferāciju un diferenciāciju par plazmas šūnām, kas ražo imūnglobulīnus un nodrošina humorālās imunitātes attīstību.
TH1 atšķir svešo (non self) antigēnu no savējiem (self), salīdzinot to ar II klases galvenā audu saderības kompleksa (MHC) antigēniem. TH1 šūnas, kas pazīst antigēnu kā svešu, aktivējas, proliferē, ražo IL-2 un gamma-IFN, kas mobilizē imūnatbildei TC, kuri lizē inficēto šūnu.
Makrofāgi
Makrofāgi (MAK) vīrusus fagocitē, sadala fragmentos un pēc apstrādes (processing) vīrusu antigēnus pasniedz (presenting) TC līdz ar MHC I antigēniem, bet TH1 - līdz ar MHC II antigēniem. Šo kompleksu sauc par superantigēnu, jo tas izraisa spēcīgu imūnatbildi.
Makrofāgi atrodas visos audos un asinīs. Tie nespecifiski eliminē antigēnu, kā arī prezentē to un piedalās imūnreakcijas efektorajā fāzē. Makrofāgi ir asins monocīti un audu makrofāgi: plaušu alveolārie, nieru mezangionālie, aknu sinusoidālās Kupfera, ādas Langerhansa, locītavu sinoviālās, CNS mikroglijas, dendrītiskās un sapirkstotās šūnas. MAK aprij (fagocitē) un sagremo mikroorganismus, bet svešos Ag apstrādā un pasniedz kā superantigēnu, t. i., ekspresē uz virsmas līdz ar II vai I klases MHC gēnu produktiem - CD4 vai CD8 limfocītiem.
Ar vīrusiem inficētās šūnas lizē arī NK, antivielas un komplements.
Komplementa sistēma
Komplementa sistēma (KS) nodrošina nespecifisko jeb dabīgo (iedzimto; angļu val. - innate) imunitāti. KS veido vairāk nekā 34 glikoproteīnu-proteolītisko fermentu kaskāde, kas veic sešas šādas svarīgas funkcijas:
- opsonizāciju,
- patogēno baktēriju un tumora šūnu līzi,
- imūnkompleksu līzi,
- inducē himiotaksi un veicina iekaisuma reakciju (C5a; C3a),
- piesaistās B limfocītu komplementa receptoram,
- regulē humorālo imūnatbildi.
Vīrusu izvairīšanās no saimnieka imūnmehānismiem
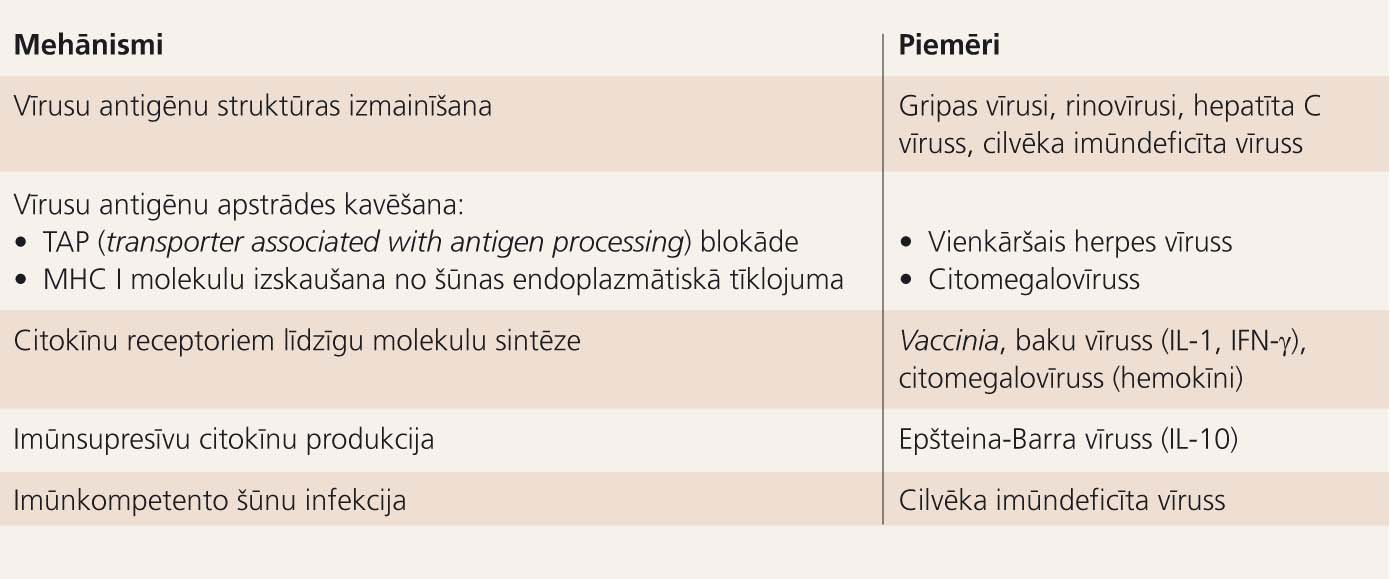
Dažādi vīrusi no saimnieka imūnsistēmas izvairās vairākos veidos (tabula).

Tabula
Vīrusu izvairīšanās no saimnieka imūnsistēmas
Antigēna struktūras izmaiņas
Daži RNS vīrusi izmaina savu antigēnu struktūru un kļūt imūnsistēmai nepazīstami. Šo izmaiņu pamatā ir RNS vīrusu genoma punktveida mutācijas vai to genoma pārkārtošanās (reassortment). Šo mehānismu spilgti raksturo gripas piemērs.
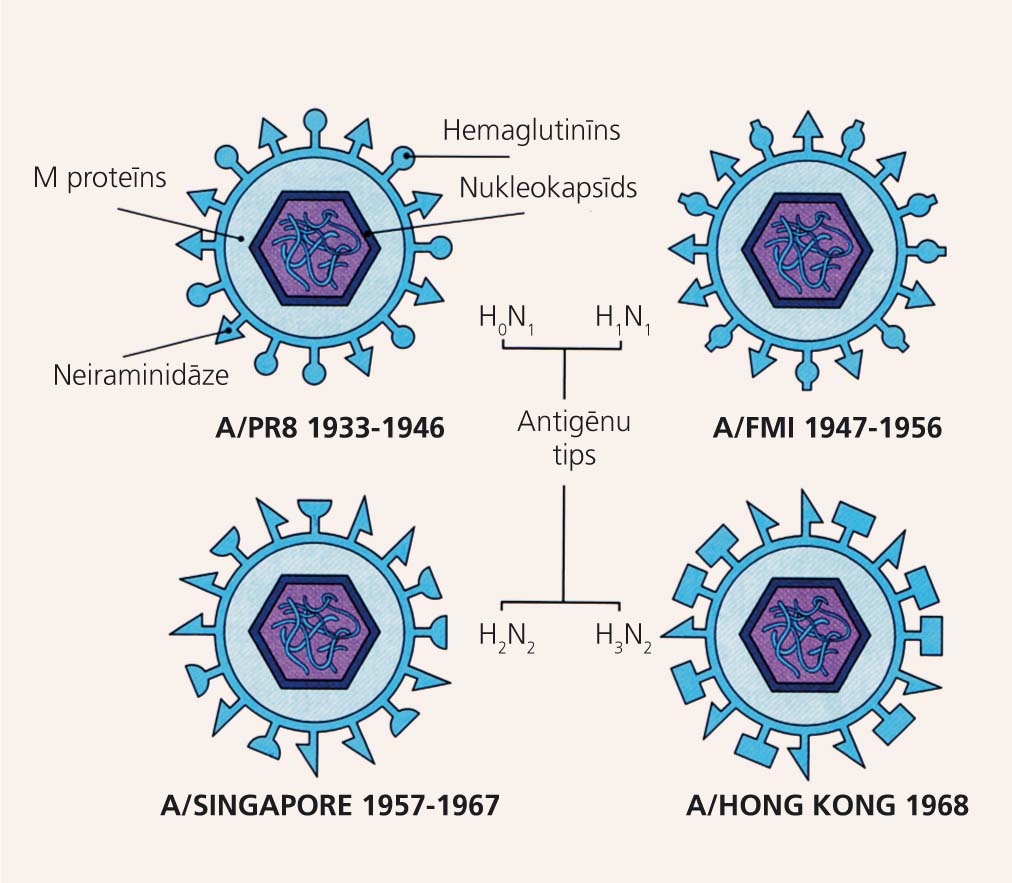
Mainība ir gripas vīrusu raksturīgākā īpašība. Gripas vīrusi maina savu izskatu kā hameleons, tāpēc gripa noris epidēmiju veidā un atkārtojas katru gadu no jauna. Visbūtiskākā gripas vīrusu īpašība ir to ārējā apvalka antigēnu mainība (drift un shift). Tā nodrošina jaunu gripas vīrusu apakštipu rašanos, pret kuriem daļai iedzīvotāju nav imunitātes, un izceļas gripas epidēmijas un pandēmijas (3. attēls).

3. attēls
A gripas vīrusu ārējā apvalka antigēnu mainība (shift) no 1933. gada
Gripas vīrusa ārējā apvalka antigēnu pakāpeniskās nelielās punktveida pārmaiņas sauc par drift, savukārt lielākas, lēcienveidīgas gripas vīrusa dzelkšņu antigēnu struktūras pārmaiņu apzīmē ar shift.
Dabīgos apstākļos, kad elpceļu epitēlija šūnu vienlaicīgi inficē cilvēka A gripas vīruss un, piemēram, putnu A gripas vīruss (H5N1), jaunā pandēmiskā A gripas vīrusa genoms var rasties, sajaucoties (rekombinējoties) cilvēka un putnu A gripas vīrusu genoma segmentiem. Rezultātā var notikt gripas vīrusa ārējā apvalka antigēnu struktūras lēcienveidīgas pārmaiņas (shift) un jauna pandēmiska gripas vīrusa apakštipa, piemēram, H2 N3, rašanās.
Mainoties vīrusa virsmas antigēniem, tā neitralizācijai nepieciešamas citādas, jaunas antivielas, kas rodas tikai no jauna saskarē ar pārmainīto, nu jau svešo antigēnu (vīrusu). Šāda atkārtota saskare izraisa atkārtotu saslimšanu ar gripu. Pārmainoties vīrusa apvalka antigēniem, cilvēkam nav imunitātes pret jauno gripas vīrusa apakštipu, tāpēc atkārtoti jāslimo ar gripu.
Virsmas antigēnu nelielās pārmaiņas notiek nepārtraukti, kā rezultātā ik pēc trīs gadiem rodas lokālas gripas epidēmijas. Lielas, lēcienveidīgas A gripas vīrusu apvalka antigēnu struktūras pārmaiņas radīja postīgas gripas pandēmijas (1918., 1957., 1968. gadā), kas aptvēra visu pasauli. Pandēmiskie cilvēka A gripas vīrusu apakštipi vienmēr ir radušies, rekombinējoties cilvēka A gripas un putnu vai dzīvnieku A gripas vīrusu segmentētajiem genomiem (4. attēls). A gripas vīrusu lielo dažādību nosaka 16 dažādu ārējā apvalka hemaglutinīna (H) antigēnu (no H1 līdz H16) un deviņu dažādu neiraminidāzes (N) antigēnu (no N1 līdz N9) kombinācijas.
Potenciālās gripas vīrusa antigēna struktūras izmaiņu konsekvences
PVO un CDC (Centers for disease control and prevention) zinātnieki uzskata, ka cilvēci pašreiz ļoti nopietni atkal apdraud jauna, postīga A gripas pandēmija, kas radīsies, rekombinējoties putnu A gripas (H5N1) un cilvēka A gripas vīrusu (H1N1 vai H3N2) segmentētajiem genomiem. Jaunā A gripas pandēmija varētu būt līdzīga 1918. gada ļoti postīgajai spāņu gripas (H1N1) pandēmijai, kas prasīja 20-50 miljonus cilvēku dzīvību. Nozīmīga loma jaunā pandēmiskā gripas vīrusa tapšanā ir cūkām, kas viegli inficējas gan ar cilvēku, gan putnu A gripas vīrusiem, tā kļūstot par savdabīgu gripas vīrusu mikseri.
Zinātnieki ir pārliecināti, ka jauna A gripas pandēmija sāksies drīz. Kāda būs jaunā pandēmiskā A gripas vīrusa antigēnā struktūra un precīzi kad jaunā A gripas pandēmija sāksies, paredzēt nespēj neviens. Efektīvu vakcīnu jaunās pandēmiskās A gripas profilaksei varēs radīt tikai divus trīs mēnešus pēc pandēmijas sākuma, kad būs zināma jaunā pandēmiskā gripas vīrusa antigēnā struktūra.


4. attēls
Jauna pandēmiska A gripas vīrusu apakštipa rašanās shēma
Ārkārtīgi liela antigēnu struktūras mainība ir arī svarīgākā rinovīrusu, HCV, HIV īpašība un cēlonis, kāpēc šo vīrusu infekcija neinducē spraigu imunitāti un nav radītas efektīvas vakcīnas to profilaksei.
Vīrusu antigēna bloķēšana
Daži vīrusi, piemēram, HSV un CMV, kavē vīrusu antigēnu apstrādi un prezentāciju. Tie bloķē MHC I. antigēnu montāžu un ekspresiju uz inficēto šūnu virsmas. Ar šiem vīrusiem inficētās šūnas, kam uz virsmas nav MHC I. antigēnu, nevar pazīt un nogalēt TC limfocīti - to spēj tikai NK.
Molekulu sintēzes stimulēšana
Ir vīrusi, piemēram, Vaccinia, baku vīrusi, CMV un citi, kas stimulē molekulu sintēzi, kas kavē gan nespecifisko, gan specifisko pretvīrusu imunitāti.
Baku vīrusi kodē tādu molekulu sintēzi, kas piesaista citokīnus, kā IFN-g, TNF, IL-1, IL-18 un citus. Šie sekundārie citokīnus piesaistošie proteīni ir konkurējoši citokīnu antagonisti. CMV stimulē molekulu sintēzi, kas ir līdzīgas MHC I antigēniem, bet EBV tādu proteīnu produkciju, kas ir makrofāgus kavējošā IL-10 analogi.
Imūnatbildi regulējošo šūnu eliminācija
HIV vīrusi spēj izdzīvot, inficējot un eliminējot svarīgākās imūnatbildi regulējošās šūnas - CD4 limfocītus.
Vīrusu infekcijas var izraisīt autoimūnas un imūnkompleksu slimības, piemēram, 25% gadījumu periarteritis nodosa izraisa HBV (pozitīvs HBsAg - vērtīgs diagnostiskais kritērijs).