Iepriekšējā numura rakstā bija vispārīgs polineiropātiju raksturojums, to diagnostikas un ārstēšanas principu apkopojums. Šajā numurā aplūkotas specifiskas iegūtas neiropātijas – diabētiskas, imunoloģiskas, multifokālas motoras, toksiskas neiropātijas – raksturojums, diagnostikas un ārstēšanas iespējas.
Diabētiskās neiropātijas
Perifērās nervu sistēmas (PNS) bojājums ir viena no biežākajām cukura diabēta komplikācijām, kas attīstās gan insulinējama, gan neinsulinējama cukura diabēta gadījumā. Dažādi diabētisko neiropātiju varianti klīniski novērojami 15% pacientu, bet elektrofizioloģiski - ne mazāk kā pusei pacientu. Ir arī ziņojumi, kur atbilstīgi neiropātijas definēšanai izmantotajiem kritērijiem un metodēm neiroloģiskās komplikācijas minētas 10-90% cukura diabēta pacientu. Apmēram 8% pacientu polineiropātiju konstatē jau diagnozes noteikšanas brīdī, līdz ar slimības ilgumu un pacienta vecumu pieaug arī perifērās nervu sistēmas bojājuma risks. Atsevišķos gadījumos neiropātija apsteidz cukura diabēta manifestāciju. Cukura diabēts ir arī par iemeslu 50-75% ne-traumas amputāciju.
Klīniskā aina
Diabētiskās neiropātijas dažādie varianti atšķiras pēc klīniskās ainas, patoģenēzes, histoloģiskām izmaiņām, norises, reakcijas uz ārstēšanu un prognozes. Dažas neiropātiju formas attīstās lēni, norit latenti, citas izpaužas akūti. Novēro arī dažādu neiropātiju formu kombinācijas, kas sarežģī diabētisko neiropātiju klasifikāciju. Tas arī ir iemesls dažādām diabētisko neiropātiju klasifikācijām.Watkins un Edmonds sagrupējuši diabētiskās neiropātijas 3 grupās.
Progresējošās neiropātijas
Progresējošās neiropātijas ir saistītas ar pieaugošo cukura diabēta ilgumu un citām cukura diabēta komplikācijām. Tās pārsvarā ir sensoras, lai gan sastopamas arī autonomas formas. Manifestācija pakāpeniska, tā nav atgriezeniska. Hroniskas sensori motoras neiropātijas:
- distālās simetriskās;
- prevalējoši sensorās;
- ar autonomu komponentu;
- ar pakāpenisku manifestāciju;
- progresējošas līdz ar diabēta ilgumu;
- no glikēmijas kontroles atkarīgās;
- no citām mikrovaskulārām komplikācijām atkarīgās.
Reversiblās neiropātijas
Reversiblās neiropātijas ir ar strauju sākumu, bieži parādās vienlaikus ar diabēta manifestāciju. Tās nav saistītas ar diabēta ilgumu vai citām diabētiskām komplikācijām. Parasti tās ir pilnībā atgriezeniskas:
- mononeiropātijas:
- proksimālās motorās neiropātijas (amiotrofijas),
- kraniālās neiropātijas (III, IV, VI parēzes),
- torokoabdominālās neiropātijas;
- akūtās sāpīgās neiropātijas:
- asociētas ar sliktu glikēmijas kontroli,
- asociētas ar strauju glikēmijas kontroli,
- ar pēkšņu sākumu,o spontāni atgriezeniskas,
- nesaistītas ar citām mikrovaskulārām komplikācijām,
- nesaistītas ar diabēta ilgumu.
Kompresijas neiropātijas
Kompresijas neiropātijas bieži novēro cukura diabēta pacientiem, bet tās nav specifiskas cukura diabētam. Nav arī saistības ar cukura diabēta ilgumu vai citām komplikācijām, piemēram, karpālā kanāla sindroms.
Diagnoze
Tā kā neiroloģiski traucējumi var būt arī kā pirmā cukura diabēta izpausme, tad glikozes līmeņa kontrole jāveic visiem slimniekiem ar PNS bojājumu. No otras puses, kritiski jāizturas pret neiroloģisku patoloģiju cukura diabēta pacientiem, lai ar šo slimību nesaistītu ikvienu neiroloģisku traucējumu. Daudzi neiroloģiskie sarežģījumi cukura diabēta pacientiem ir visai nespecifiski, piemēram, distālā diabētiskā PNP klīniski maz atšķiras no citām metabolām vai toksiskām PNP (urēmijas, alkoholisma, reimatoloģisko slimību, hipotireozes, intoksikāciju, amiloidozes, paraproteinēmijas, paraneo-plastisku sindromu gadījumā). Tāpēc diabētiskas neiropātijas diagnozi var noteikt tikai pēc tam, kad izslēgtas visas pārējās slimības, kas varētu veicināt līdzīgu sindromu.
Ārstēšana
Diabētiskas neiropātijas stabilizācijā un regresēšanā galvenais nosacījums ir cukura līmeņa korekcija asinīs. Pagaidām vēl nav pierādījumu par to, ka pāriešana no perorāliem līdzekļiem uz insulīnu paātrinātu diabētiskas neiropātijas uzlabošanos. Svarīga nozīme ir ķermeņa masas normalizēšanai un lipīdu korekcijai asinīs. Praksē bieži lieto B grupas vitamīnus un pentoksifilīnu, par kuru lietošanas rezultātiem ir daudzas publikācijas un empīriski uzkrāti dati, bet to efektivitāte vēl nav pierādīta plašos nejaušināta iedalījuma daudzcentru pētījumos. Pēdējos gados izmanto tioktacīdu (α-liponskābes preparātus), smagos gadījumos i/v ievadot 300-600 mg 3-4 reizes nedēļā, pārejot uz p/o preparāta lietošanu tajā pašā devā vēl 2 mēnešus. Tiek pētīta aldozes reduktāzes (albrestatīns, tolrestats) efektivitāte, kā arī gangliozīdu un salikto sialoglikolipīdu, kas stimulē aksonu reģenerāciju, efektivitāte, bet šobrīd šos preparātus vēl nevar rekomendēt plašai lietošanai. Neskaidra paliek imūnterapijas nozīme simetrisko proksimālo motoro neiropātiju gadījumā.Īpaši grūti ārstēšanai pakļaujas perifērā veģetatīvā nepietiekamība. Ortostātiskās hipotensijas mazināšanai rekomendē gulēt ar augstu spilvenu, izmantot elastīgās zeķes, strauji nemainīt ķermeņa stāvokli, samazināt devu vai nelietot asinsvadus paplašinošus līdzekļus, palielināt sāls daudzumu uzturā, samazināt alkohola lietošanu. Ja nemedikamentozie pasākumi nav efektīvi, var ordinēt fludrokortizonu, midodrīnu vai dihidroergotamīnu, kā palīglīdzekļus var lietot nesteroīdos pretiekaisuma līdzekļus, dažreiz β blokatorus (pindololu).
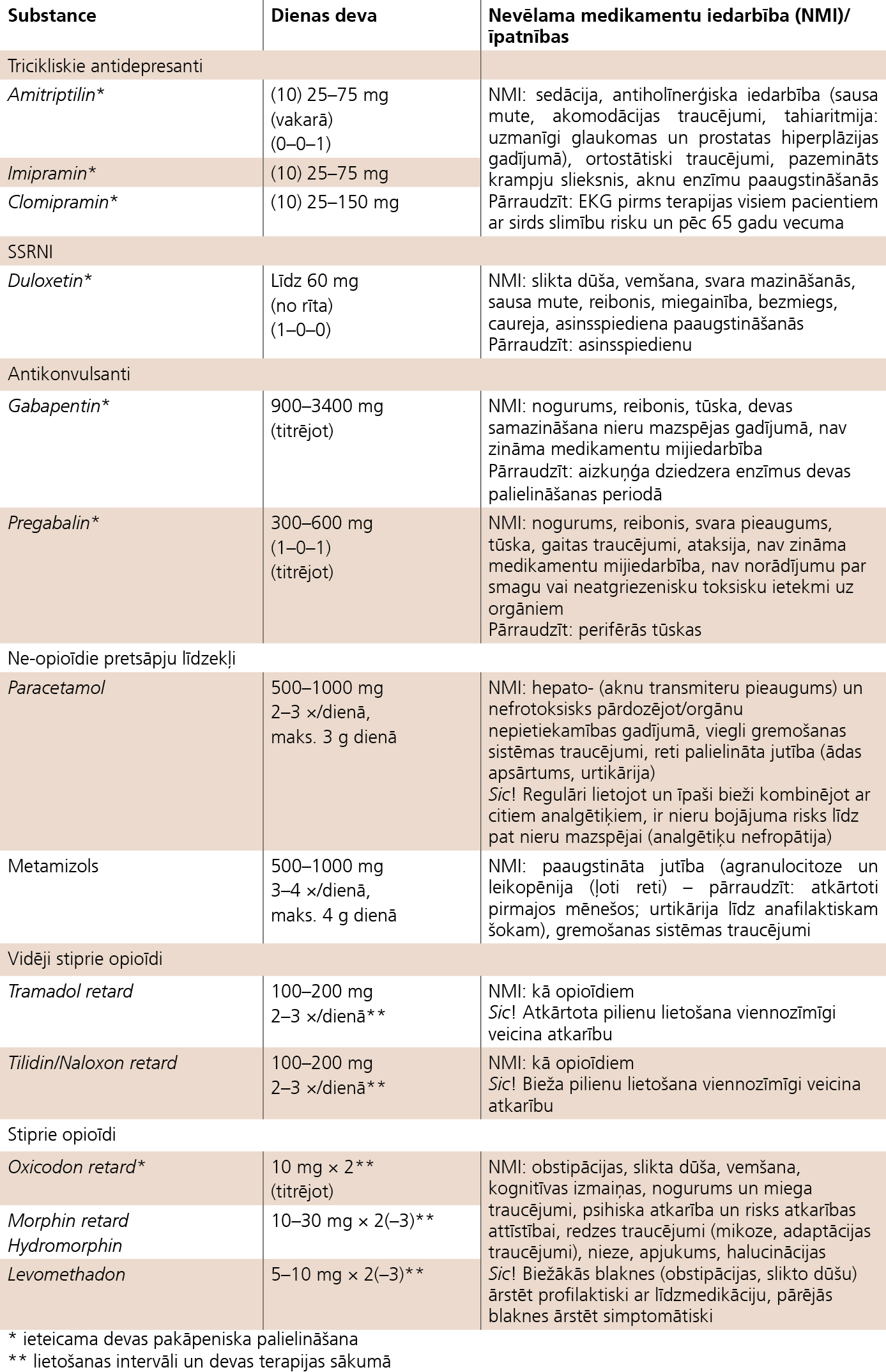

1. attēls
Sensori motoro diabētisko PNP sāpju terapijas medikamentu pārskats (Nationale VersorgungsLeitlinie 20.02.2012, AWME-Register Nr.nvi-001e)
Simptomātiska neiropātisko sāpju terapija
Liela nozīme ir simptomātiskai neiropātisko sāpju terapijai. Pastāvīgu dedzinošu sāpju gadījumā bez analgētiķiem un nesteroīdajiem pretiekaisuma līdzekļiem (NPL) efektīvāki ir tricikliskie antidepresanti (amitriptilīns, nortriptilīns, anafranils). Ja pacients slikti panes šos preparātus, var lietot serotonīna atpakaļsaistes inhibitorus (SSRI), taču patoģenētiski tie mazāk ietekmē sāpju mehānismus. Jāņem vērā, ka antidepresantu pretsāpju efekts izteiktāks ir ar mazām un vidējām devām, svarīga arī šo preparātu izmantošanas taktika un titrēšana, tos sākot. Šaujošu sāpju gadījumā efektīvi ir pret-epilepsijas līdzekļi, piemēram, gabapentīns, ir plaši pētījumi par pregabalīna efektivitāti diabētiskās neiropātijas ārstēšanā. Neiropātisko sāpju ārstēšanai tiek piedāvātas arī dažādas shēmas, kas nav pretrunā cita citai.
Sāpīgas diabētiskas neiropātijas aprūpe un ārstēšana
Sāpīgas diabētiskas neiropātijas aprūpe un ārstēšana (Salomon Tesfaye, Diabetic neuropathy, 2002):
- izslēgt citus neiropātijas cēloņus;
- glikēmijas kontroles optimizēšana;
- psiholoģisks atbalsts pacientam;
- nefarmakoloģiska ārstēšana, piemēram, pasargāšana no kontakta sāpēm;
- farmakoloģiska ārstēšana:
- glikēmijas kontroles optimizēšana (ja nepieciešams, ar insulīnu II tipa cukura diabēta gadījumā),
- tricikliskie antidepresanti (imipramīns vai amitriptilīns, 25-150 mg vakarā; ja nepanes tricikliskos antidepresantus - SSRI),
- antikonvulsanti (gabapentīns 900-3600 mg/dienā, titrējot devu, karbamazepīns 200-800 mg/dienā),
- tramadols (50-400 mg/dienā),
- lidokaīna plāksteri.
Sensori motoro diabētisko neiropātiju ārstēšanas shēmu un medikamentus skat. 1. tabulā.
Imunoloģiskās (disimūnās) PNP: Gijēna-Barē (Guillain-Barre) sindroms (GBS)
Vispārējs raksturojums
Var būt akūts un hronisks. No dažām dienām līdz 4 nedēļām. Demielinizējošas, motoras, simetriskas PNP (apmēram 70% "klasiska GBS"). Jauktas formas (20%), aksonālas (10%).
GBS etioloģija un patoģenēze
GBS etioloģija nav skaidra. Ir hipotēze, ka antivielu reakcija pret perifēro mielīnu un/vai pret aksonu membrānu. Sava loma arī T limfocītiem, audzējnekrozes faktoram (α TNF), citokīniem (interferoniem, interleikīnam-12) un GM1 Av.GBS predisponējošie faktori:
- iepriekšēja elpceļu infekcija pirms 1-3 nedēļām (piemēram, mikoplazmu pneimonija);
- gastroenterīti (piemēram, Campylobacter jejuni, diareja anamnēzē), CMV, VZ, EBV;
- operācijas, traumas, grūtniecība.
GBS klīniskā aina
- Parestēzijas un/vai sāpes (90%), sākas kājās, vēlāk rokās.
- Atipisks sākums - rīšanas traucējumi, proksimāla roku parēze vai proksimāla paraparēze priekšplānā.
- Parēzes: šļauganas, parasti simetriskas, progresējošas dienu (stundu) laikā, elpošanas traucējumi, iesaistoties diafragmai.
- Cīpslu refleksi izzūd.
- Kraniālo nervu izpausmes: n. facialis parēze (50%), bieži abpusēji.
- Jušanas traucējumi niecīgi, bet mēdz būt.
- Autonomie traucējumi (biežākais nāves cēlonis), iesaistoties aferentām un eferantām šķiedrām. Pēc Lihtenfelda:
- izteikta simpatiskās sistēmas aktivācija: hipertonija, svīšana,
- novājināta simpatiskās sistēmas aktivācija: ortostātiska hipotonija,
- izteikta parasimpatiskā aktivācija: bradikardija,
- novājināta parasimpatiskā aktivācija: tahikardija, sfinkteru disfunkcija,o pastiprināta/novājināta - ADH atbrīvošanās - Diabetes insipidus,
- tetraplēģija, izteikta arteriālā spiediena variabilitāte - risks bradikardijai/asistolijai,
- bradikardijas/asistolijas cēloņi: atsūkšana, elpināšana, žokļa atvēršana, kompresija.
Papildu diagnostika
Likvors: palielināts olbaltumu saturs līdz 10 000 mg/l. Šūnu daudzums - normāls (citoalbumināra disociācija). Pirmajā slimības nedēļā līdz 50% gadījumu likvors ir normas robežās!!!
EKG: ritma traucējumi, AV blokādes.
Neirogrāfija: pagarināta F viļņu latence, pagarināts distāli motorais latentums, palēnināts nervu impulsu vadīšanas ātrums, bieži vadīšanas bloki un samazinātas amplitūdas.
Elektromiogrāfija: patoloģiska spontānā aktivitāte 2-3 nedēļas pēc slimības sākuma - sekundāra aksonāla bojājuma izpausme.
Seroloģija: GM1 antivielas.
Diferenciāldiagnoze
Diferenciāldiagnoze - citas slimības:
- spināli procesi - mielīts, tilpumprocess, išēmija;
- vīrusi - EBV, CMV, HIV, poliomielīts, VZV, HS, B hepatīts;
- baktērijas - botulisms, difterija, mikoplazma;
- paraneoplastisks sindroms;
- kritiskā stāvokļa neiropātija - miopātija;
- stāvokļi pēc vakcinācijas, vaskulītiem, akūtām miopātijām;
- Myastenia gravis; elektrolītu disbalanss, porfīrija, intoksikācija.
Apstākļi, kas liek apšaubīt GBS diagnozi:
- drudzis saslimšanas sākumā;
- izteikta parēžu asimetrija;
- urinācijas traucējumi;
- izteikti jušanas traucējumi;
- palielināta citoze likvorā.
GBS ārstēšana
Imūnglobulīni
Imūnglobulīni - 1. izvēles līdzekļi (tikpat efektīvi kā plazmaferēze, bet mazāk komplikāciju). Indikācijas: smaga, progresējoša norise, agrīni elpošanas traucējumi, slimības ilgums < 14 dienām. Devas: 0,4 g/kg 5 dienas. Kontrindikācija: Ig A deficīts (anafilaktiska reakcija).Plazmaferēze: imūnglobulīnu kontrindikāciju gadījumā, to komplikācijas vai neefektivitāte (5 asins apmaiņas procedūras 1-2 nedēļās).
Simptomātiska terapija
- Trombozes profilakse.
- MPV - elpošanas traucējumu gadījumā (GBS).
- Autonomo simptomu korekcija: hipertonija, tahikardija, bradikardija, bradiaritmija, AV blokādes (EKS).
- Sāpju terapija - karbamazepīns, opiāti.
Prognoze
Nelabvēlīgie faktori: vecums > 60 gadiem, iepriekšēja Campylobacter infekcija, paaugstināts GM1 Av titrs, neirogrāfiski sākotnēji zemas muskuļu reakcijas amplitūdas un/vai EMG izteikts aksonāls bojājums pēc 2-3 nedēļām.
Jaunumi akūtu un hronisku disimūnu neiropātiju un neirītu terapijā
Nejaušināta iedalījuma kontrolētā pētījumā noguruma sindroma gadījumā pēc Gijēna-Barē sindroma amantadīna efektivitāte nav apstiprinājusies (Garssen et al. 2006).Retrospektīvā pētījumā, salīdzinot plazmaferēzes, imūnadsorbcijas un intravenozo imūnglobulīnu (i/v Ig) ietekmi uz GBS rezultātiem, nebija atšķirību (Seta et al. 2005).Metilprednizolona un lielu devu i/v Ig kombinācija GBS gadījumā neuzrādīja nekādas priekšrocības, salīdzinot ar i/v Ig monoterapiju (van Koningsveld et al.2004).Līdz šim lielākajā nejaušināta iedalījuma pētījumā tika dokumentēts i/v Ig pārākums pār placebo hronisku iekaisīgu demielinizējošu polineiropātiju (CIDP) terapijā gada laikā (Hughes et al 2008).Pacienti tikai ar "iespējamu" CIDP (pēc INCAT kritērijiem) gūst labumu no imūnterapijas tāpat kā pacienti ar apstiprinātu CIDP (Chan et al.2006).Atklātā pētījumā ar Rituximab novēroja uzlabošanos pacientiem ar anti-MAG-pozitīvu IgM asociētām neiropātijām, īpaši pacientiem ar ievērojami paaugstinātu antivielu titru (Benedetti et al. 2007).Nejaušināta iedalījuma kontrolētā pētījumā ar 28 pacientiem ar multifokālu motoru neiropātiju (MMN) neizdevās iegūt i/v Ig ietaupījumu, kombinējot to ar Mycophenolatmofetil (Piepers et al. 2007).Nelielā atklātā perspektīvā pētījumā neizdevās pierādīt i/v Ig ietaupījumu pacientiem ar MMN, kombinējot to ar Rituximab (Gorson et al. 2007).Retrospektīva analīze ar 100 vaskulītiskas polineiropātijas pacientiem, no kuriem 11 bija ar izolētu PNS vaskulītu, uzrādīja labu reakciju uz imūnsupresīvu terapiju un zemus recidīvu rādītājus, izmantojot terapijas shēmas ar Cyclophosphamide (Mathew et al. 2007).
Svarīgākie ieteikumi
GBS
I/v Ig terapija un plazmaferēze akūta GBS ārstēšanā ir līdzvērtīga, un abas metodes ir labākas par placebo. To kombinācija nav efektīvāka par katru metodi atsevišķi. Kortikosteroīdiem GBS gadījumā nav efekta. Lai izvairītos no potenciāli fatālām komplikācijām, nepieciešama kardiālo un vitālo rādītāju pārraudzība, kā arī intensīvās terapijas pieejamība.
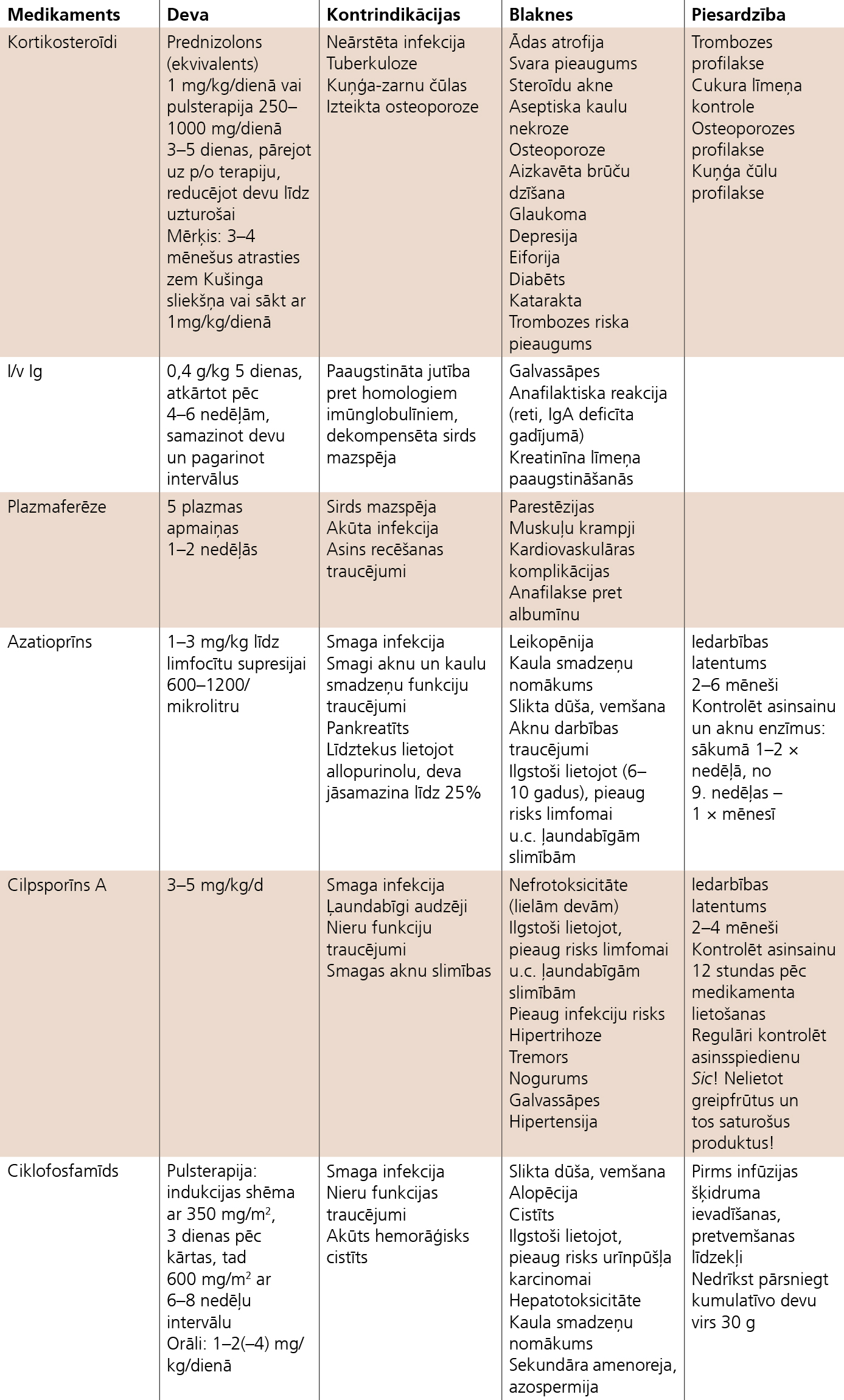

2. attēls
Hroniskas iekaisīgas demielinizējošas polineiropātijas (CIDP) terapija (AWMF-Leitlinien-Register Nr.030/130, 2008; Therapie akuter un chronischer immunvermittelter Neuropathien und neuritiden)
Hroniska iekaisīga demielinizējoša polineiropātija (CIDP)
Akūtās terapijas ietvaros 6 nedēļu periodā steroīdi, i/v Ig terapija un plazmaferēze ir līdzvērtīgas metodes. Ilgtermiņa terapijai ieteicams izvēlēties iespējami mazākas devas/frekvences terapiju, kāda bija efektīva akūtajā posmā. Ja ir neadekvāta reakcija uz terapiju vai lielas uzturošās devas, vajadzētu izvēlēties kombinētu terapiju vai papildu imūnsupresantu pievienošanu. Hroniskas iekaisīgas demielinizējošas polineiropātijas (CIDP) terapiju skat. 2. tabulā.
Paraproteinēmiskā neiropātija
Demielinizējošas neiropātijas ar IgG un IgA paraproteīniem monoklonālas gammopātijas (MGUS) gadījumā klīniski un ar reakciju uz terapiju parasti neatšķiras no CIDP, tāpēc to var ārstēt pēc CIDP principiem.Demielinizējošās neiropātijas ar IgM - paraproteīnu slikti reaģē uz CIDP pamatterapiju. Var izmantot i/v Ig terapiju, plazmaferēzi vai imūnsupresantus.Nejaušināta iedalījuma kontrolētā pētījumā ar 35 pacientiem ar IgM asociētu neiropātiju, izmantojot intermitējošu kombinētu terapiju ar ciklofosfamīdu (500 mg p/o 4 dienas) un prednizolonu (60 mg p/o 5 dienas), atkārtojot ik pēc 28 dienām, pēc 6 mēnešiem nevarēja novērot uzlabošanos pēc klīniskām skalām, bet varēja noteikt ievērojamu muskuļu spēka un jušanas uzlabošanos (Niermeijer et al. 2007).Vairākos atklātos pētījumos par Rituximab novēroja uzlabošanos pacientiem ar anti-MAG-pozitīvu IgM asociētām neiropātijām (Benedetti et al. 2007, Levine, Pestronk 1999, Renaud et al. 2006).
Multifokāla motora neiropātija (MMN)
Izvēles terapija MMN gadījumā ir i/v Ig lielās devās.
Vaskulītiskas neiropātijas
Vaskulītiskas neiropātijas kā sistēmiska vaskulīta manifestāciju ārstē pēc sistēmiskā vaskulīta principiem. Tīri autoimūnas ģenēzes gadījumā terapijā lieto kortikosteroīdus kombinācijā ar citostātiķiem, piemēram, ciklofosfamīdu. Vīrusu ģenēzes imūnkompleksu veicināta vaskulīta gadījumā (piemēram, B hepatīts) papildus jālieto virostātiski līdzekļi.Ciklofosfamīda toksicitātes dēļ, sasniedzot remisiju, vēlākais pēc 6-12 mēnešiem, ciklofosfamīds jāaizvieto ar azatioprīnu vai metotreksātu.Perifēro nervu izolēts vaskulīts (nesistēmiskā vaskulītiskā neiropātija) jāārstē ar kortikosteroīdiem, smagos gadījumos var pievienot imūnsupresantus (piemēram, azatioprīnu).
Simptomātiska un atbalsta terapija
Simptomātiskās terapijas iespējas: ārstnieciskā vingrošana, ergoterapija, nodrošinājums ar palīglīdzekļiem (šinām, spieķiem) un pretsāpju terapija kā neiropātisku sāpju gadījumā.Tā kā visi nosauktie medikamenti var potenciāli izraisīt blaknes, tas adekvāti jāizskaidro pacientam un jāgādā par blakņu profilaksi.
Toksikās neiropātijas
Polineiropātija (PNP) ir viena no biežākajām nervu sistēmas reakcijām uz ķīmiskiem toksīniem. Polineiropātiju var izraisīt rūpnieciskie un vides faktori, smagie metāli, atkarības vielas un medikamenti. No medikamentiem toksiskākie ir vēža terapijai lietotie. Neirotoksiskie faktori var izraisīt distālu aksonālu deģenerāciju (aksonopātiju), nervu šūnu ķermeņu deģenerāciju (neironopātiju, piemēram, metil-merkūrijs, piridoksīns, doksirubicīns) vai primāru demielinizāciju (mielinopātiju, piemēram, perheksilēns, amiodarons). Lielākā daļa toksīnu izraisa aksonālas neiropātijas, primāri bojājot resnākos un garākos aksonus, procesam izplatoties no distālajām daļām uz proksimālajām. Klīniski novēro agrīnu jušanas zudumu pēdās, Ahileja refleksu zudumu, vēlāk - distālu kāju vājumu un muskuļu atrofiju. Daudzu toksisko aksonopātiju gadījumā tiek skarta arī centrālā nervu sistēma (CNS), attīstās distāla kortikospinālā trakta, mugurējo stabu un n. opticus deģenerācija. Lielākā daļa toksisko neiropātiju ir pašlimitējošas un pēc toksiskā faktora iedarbības pārtraukšanas pakāpeniski pāriet.Lai novērtētu toksiskā faktora ietekmi un saistītu to ar neiropātijas attīstību, jāņem vērā kritēriji:
- jāprecizē toksiskā faktora ekspozīcija un tās saistība ar klīnisko simptomu sākumu. Neiropātiskie simptomi atbilstīgi ekspozīcijai parasti attīstās 2-3 nedēļās;
- starp klīniskajām pazīmēm jābūt subjektīvajiem simptomiem, neiroloģiskajiem simptomiem un izmaiņām elektrofizioloģiskajos izmeklējumos;
- jāizslēdz citi iespējamie slimības cēloņi;
- ekspozīcijas pārtraukšana izraisa remisiju vai novērš slimības progresēšanu.
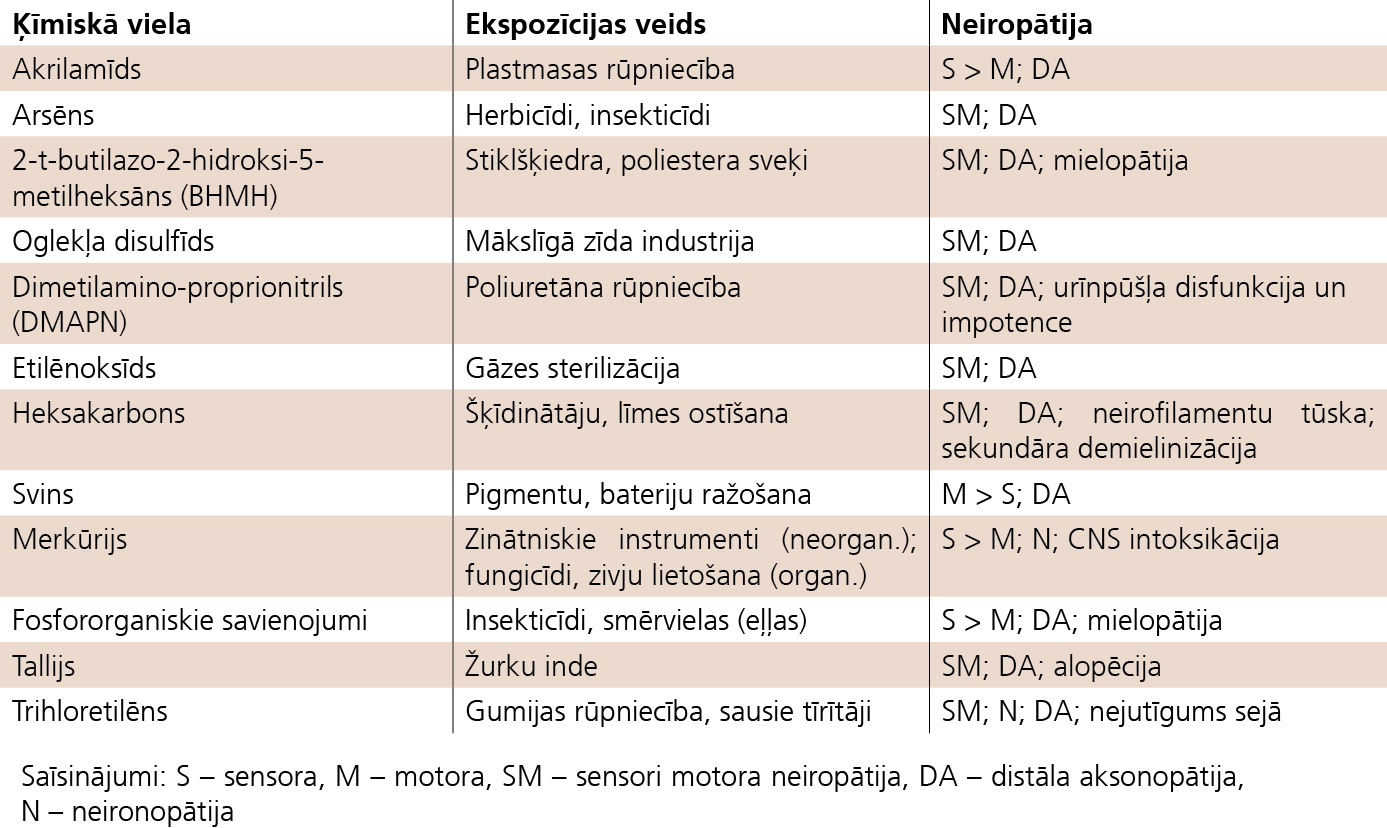

3. attēls
Rūpniecisko un vides toksīnu izraisītas toksiskas neiropātijas
Perifēro nervu bojājumus izraisa plašs toksisko faktoru spektrs: eksogēnie toksīni - alkohols, organiskie šķīdinātāji, metāli (svins, dzīvsudrabs, alva, tallijs, platīns, žurku inde, arsēns), fosfororganiskie savienojumi, akrilamīds un medikamenti.Rūpniecisko un vides toksīnu izraisītās toksiskās neiropātijas skat. 3. tabulā.
Medikamentu inducētas polineiropātijas
Iespējamie toksiskie medikamenti: amiodarons, cisplatīns, dabsons, disulfirāms, gentamicīns, fenitoīns, hidralazīns, hloramfenikols, hlorokvinils, hlorjodhidroksihinolins, litijs, izoniazīds, imipramīns, indometacīns, interferons, jautrīdas gāze (N2O), lipīdus pazeminošie līdzekļi, kolhicīns, metronidazols, nitrofurāni, difenīns, zelta preparāti, vinblatīns, vinkristīns, penicilīns, perheksilīnmaleāts, prokaīnamīds, propafenons, piridoksīns lielās devās, antiretrovirālie līdzekļi, takrolīms, taksols, talidomīds.Klīniskajai ainai raksturīgas distālas simetriskas PNP ar izteiktu sensoru raksturu, daļā gadījumu ar izteiktām sāpēm. Elektrofizioloģiski konstatē aksonālu bojājumu. Izņēmums ir amiodarona un perheksilīnmaleāta inducētās PNP, kuru gadījumā var attīstīties demielinizācija.PNP smagums atkarīgs no devas. Pēc pirmajiem simptomiem atceļot medikamentu, gaidāma atveseļošanās (skat. 4. tabulu).
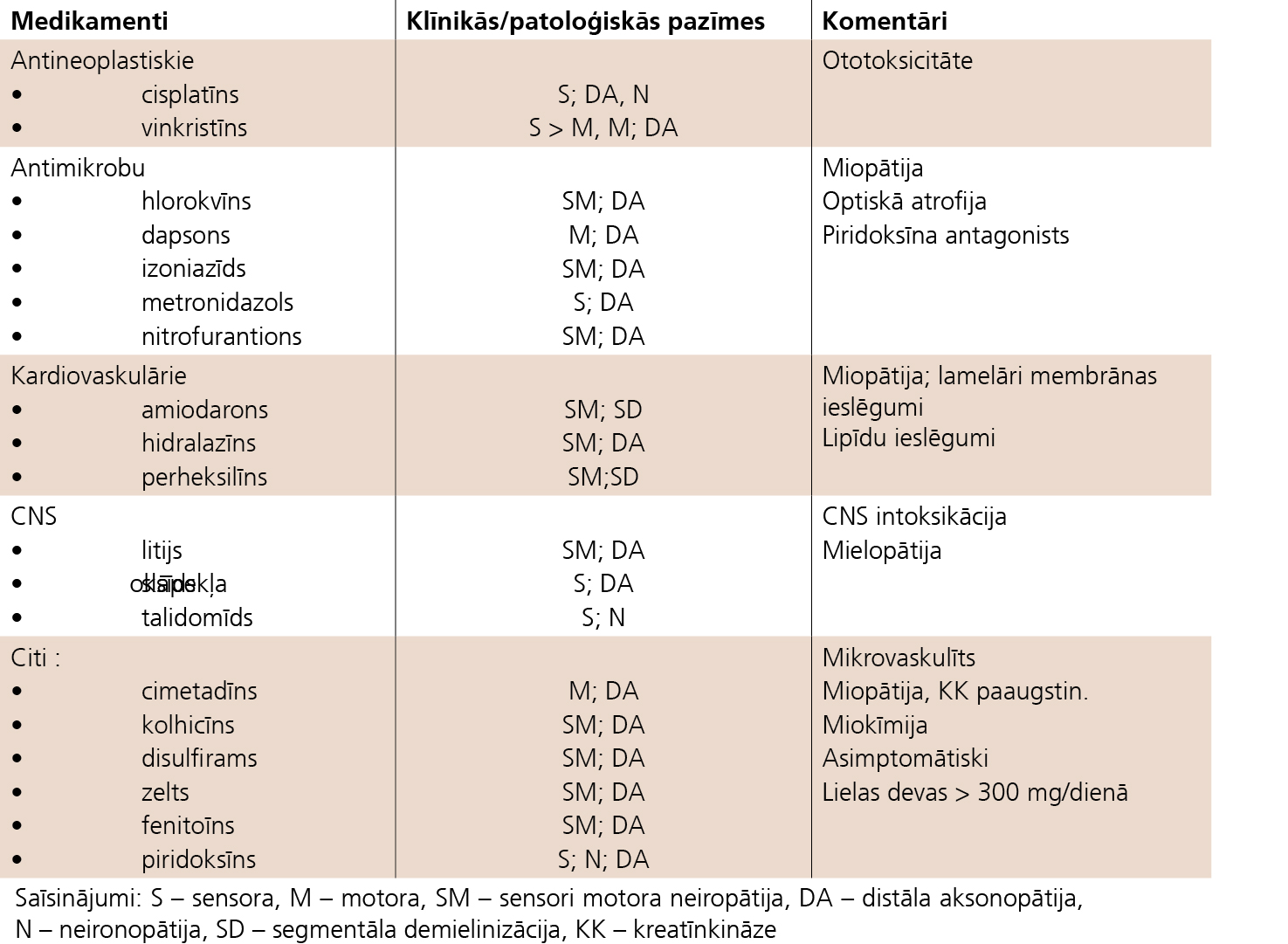

4. attēls
Medikamentu inducētas neiropātijas
Alkohola izraisīta polineiropātija
Alkohola polineiropātijas novēro 10-30% alkoholiķu. Tas ir otrs biežākais PNP tips pēc diabēta PNP. Klīniski parasti tās ir simetriskas sensoras vai sensori motoras PNP, ko bieži pavada sāpes un autonomās nervu sistēmas bojājuma pazīmes. Morfoloģiski - primāra aksonāla deģenerācija. Par alkohola tiešo toksisko ietekmi tiek diskutēts kā par prevalējošo patoģenētisko mehānismu.Etioloģija: alkohola PNP var attīstīties tiešas alkohola (acetaldehīdu) toksiskās ietekmes, tiamīna deficīta rezultātā un citu B grupas vitamīnu un folskābes deficīta dēļ, kam iemesls ir nepilnvērtīgs uzturs.Klīniskā aina Dedzinošas sāpes, nejutīgums un parestēzijas pēdās un apakšstilbos, sāpīgas muskuļu spazmas kājās un parēzes attīstās pakāpeniski, retāk - akūti, progresējot vai stabilizējas uz ilgu laiku. Iesaistoties dziļās jušanas šķiedrām, var attīstīties sensitīva ataksija.Objektīvā apskatē konstatē:
- cīpslu refleksu pazemināšanos vai izkrišanu (sākotnēji Ahileja refleksu), "cimdu un zeķu tipa" hipestēziju;
- muskuļu atrofiju distālajās kāju muskuļu grupās;
- sāpīga ir muskuļu palpācija, allodīnija;
- ilgstošas slimības norises gadījumā pievienojas muskuļu vājums un atrofija proksimālajās kāju muskuļu grupās un rokās;
- kraniālā inervācija parasti paliek neskarta, bet tikai retos gadījumos novēro vieglus bulbārus un acu ābolu kustību traucējumus;
- veģetatīvie traucējumi izpaužas ar izmainītu zīlīšu reakciju, hiperhidrozi pēdās un plaukstās, ādas krāsas izmaiņām, ādas hiperpigmentāciju un tūsku, distrofiskām nagu izmaiņām un impotenci;
- lielai daļai alkoholiķu PNP norit subklīniski, un to var atklāt tikai ar elektrofizioloģiskām izmeklēšanas metodēm;
- histoloģiski atrod aksonu distālo daļu deģenerāciju un sekundāru demielinizāciju.
Diferenciāldiagnoze
Jāatceras, ka PNP alkoholisma slimniekiem ne vienmēr izraisa alkohols. Līdzīgus PNP variantus novēro arī cukura diabēta, urēmijas un vaskulīta pacientiem. Ja akūti attīstās šļaugana tetraparēze, jādomā par iekaisīgi autoimūnu sindromu, kas nav saistīts ar alkoholismu, vai akūtu alkohola miopātiju.
Ārstēšana
Alkohola PNP progresēšanu var apturēt un stāvokļa uzlabošanās iespējama:
- ar atteikšanos no alkohola;
- lietojot pilnvērtīgu uzturu;
- lietojot tiamīna un citus B grupas vitamīnus un folskābes preparātus.
Stāvokļa uzlabošanās ir lēna un ne vienmēr pilnīga. Indicēti arī fiziskie vingrojumi muskuļu nostiprināšanai un kontraktūru profilaksei. Sāpju terapijā izmanto anti-depresantus un pretepilepsijas līdzekļus.
Literatūras sarakstu skat. iepriekšējā numurā pie raksta I daļas.