Biozāles mūsdienās izmanto daudzās klīniskās medicīnas nozarēs, piemēram, dermatoloģijā, gastroenteroloģijā, hematoloģijā, endokrinoloģijā, neiroloģijā, onkoloģijā, reimatoloģijā. Tās plaši lieto tādu autoimūno slimību kā multiplā skleroze, reimatoīdais artrīts, Krona slimība u. c. ārstēšanā. Pēdējos gados biozāles strauji ienākušas dažādās medicīnas nozarēs, to lietojuma indikācijas joprojām tiek pētītas.
Ziņojumu apkopoja prof. Dr. habil. med. Māris Baltiņš
Dokumentu izstrādāja ekspertu darba grupa: doc. Dr. biol. Jānis Ancāns, asoc. prof. Dr. habil. med. Dace Baltiņa, asoc. prof. Dr. med. Simona Doniņa, Dr. Anda Kadiša, doc. Dr. med. Ilze Konrāde, prof. Dr. med. Aivars Lejnieks, prof. Dr. med. Ināra Logina, Dr. Zane Neikena, prof. Dr. med. Valda Staņēviča
Dokumenta projekta prezentācija un pieaicināto speciālistu diskusija notika 2013. gada 4. septembrī Veselības ministrijas sēžu zālē. Diskusiju vadīja prof. Dr. med. Aivars Lejnieks. Papildinājumus bez ekspertu grupas locekļiem iesūtīja: Dr. Ingūna Adoviča, asoc. prof. Dr. habil. med. Daina Andersone, prof. Dr. med. Juris Pokrotnieks
Šajā dokumentā piemēru veidā plašāk esam apskatījuši biozāļu lietošanu endokrinoloģijā, onkoloģijā, bērnu un pieaugušo reimatoloģijā un neiroloģijā, bet jāuzsver, ka tas nebūt neaptver visas nozares, kur Latvijā uzkrāta pieredze par šo zāļu lietošanu.
Biozāles endokrinoloģijā
Endokrinoloģija kā nozare ir viena no biozāļu lietošanas aizsācējām un plašākajām izmantotājām. Tas viegli saprotams, jo lielākā daļa cilvēka hormonu ir peptīdhormoni, kas pēc uzbūves var būt tiklab nelielas peptīdu molekulas (piem., tireotropā hormona atbrīvtājhormons - TRH), kā vidēji lieli peptīdi (piemēram, insulīns, glikagons) vai pat ļoti sarežģītas struktūras olbaltumvielas (piem., luteinizējošais hormons - LH). Mūsdienās dažus šos peptīdhormonus mēdz izmantot diagnostiskajos funkcionālajos testos, tomēr visbiežāk tos lieto konkrētu slimību ārstēšanā. Otrs inovatīvs biozāļu izmantošanas virziens (pagaidām galvenokārt II un III fāzes klīniskajos pētījumos) ir autoimūno slimību profilakse (galvenokārt I tipa cukura diabēta slimniekiem).
Svarīgāko biozāļu piemēri endokrinoloģijā
Somatropinum - rekombinētās DNS tehnoloģijas ceļā iegūta olbaltumviela ar 191 aminoskābi, kuru sekvence ir identiska cilvēka somatotropajam hormonam. Preparātu lieto substitūcijas terapijā bērniem ar augšanas hormona deficītu, kā arī priekšlaikus dzimušiem bērniem bez augšanas pīķa līdz trīs gadu vecumam, pacientiem ar Tērnera (Turner) sindromu, Prēdera-Villija (Prader-Willi) sindromu, hronisku nieru mazspēju un ahondroplāziju. Pēdējos gados augšanas hormonu lieto arī pieaugušajiem ar augšanas hormona deficītu un kursu veidā pēc smagām neiromuskulārām traumām.
Triptorelinum - gonadotropisko hormonu atbrīvtājhormona agonists (GnRH agonists), kas, pastāvīgi stimulējot adenohipofīzi, samazina luteinizējošā hormona (LH) un folikulus stimulējošā hormona (FSH) pulsatilo sekrēciju. Endokrinoloģijā triptorelīnu izmanto centrālas dabas priekšlaicīgas pubertātes terapijā, retāk - mākslīgās apaugļošanas procedūras ietvaros.
Augšanas hormona receptoru antagonisti ir augšanas hormona analogi, kuru molekula gēnu inženierijas ceļā mērķtiecīgi mainīta, lai medikaments ļoti tiecīgi fiksētos pie vienas augšanas hormona receptora apakšvienības, bet nesaistītos ar otru, novēršot receptoru dimerizāciju un hormona bioloģiskos efektus. No tiem praksē akromegālijas pacientiem, kam terapija ar somatostatīnu izrādījusies neefektīva, visplašāk lieto Pegvisomantum.
Reproduktīvajā endokrinoloģijā neauglības ārstēšanai plaši lieto Follitropinum alfa/beta (r-hFSH), lutropin alfa (r-hLH), Choriogonadotropinum alfa (r-hCHG), kā arī jau pieminētos GnRH agonistus Ganirelixum, Cetrorelixum.
Tirotropīns alfa (rhTSH) tiek lietots pacientiem ar diferencētu folikulāru un papilāru vairogdziedzera vēzi, kuriem nepieciešama radioaktīvā joda terapija vai indicēta kontroles scintigrāfija un/vai tireoglobulīna noteikšana pēc TSH stimulācijas.
Glucagonum (rDNS tehnoloģijas produkts, izmantojot Saccharomyces cerevisiae) ir cilvēka glikagonam pēc struktūras identisks hormons, ko izmanto glikēmijas līmeņa paaugstināšanai pacientiem ar biežām hipoglikēmijām un diagnostiskajos testos ar mērķi novērtēt endogēnā insulīna atlieku sekrēciju vai augšanas hormona hipofizāro stimulāciju.
Parathormona peptīdus, piem., teriparatidum, kas ir rekombinēts cilvēka PTH fragments no pirmajām 34 aminoskābēm, izmanto smagas osteoporozes terapijā.
Visi Latvijā lietojamie insulīna preparāti - gan cilvēka insulīnpreparāti (Insulinum humanum), gan īslaicīgas (Insulinum lispro, Insulinum aspart, Insulinum glulisine) un ilgstošas darbības insulīna analogi (Insulinum glargine, Insulinum detemir) - ir rekombinētās DNS tehnoloģijas produkti.
I tipa cukura diabēta profilaksei klīniskajos pētījumos izmēģinātas ļoti daudzas biozāles, bet izvirzītie mērķi nav sasniegti. Šobrīd III fāzes pētījumos visperspektīvākie rezultāti (resp., C peptīda lēnāka samazināšanās) iegūti ar Teplizumab (Fc monoklonālās antivielas) un Abatacept (T šūnu aktivācijas inhibitors).
Visas šīs zāles ir proteīni, ko ievada parenterāli, tāpēc rīcībā ar tām, lai saglabātu efektivitāti, jāievēro īpaši transportēšanas un uzglabāšanas noteikumi (aukstuma ķēdes nepārtrauktība).
Jau kopš 1998. gada EMA un ASV Pārtikas un zāļu pārvalde (Food and Drug Administration, FDA) izskata iesniegumus par biolīdzinieku reģistrāciju un izmantošanu klīniskajā praksē, daļa no kuriem (atsevišķi insulīna preparāti, augšanas hormons, glikagons, tirotropīns alfa) jau atļauti lietot atsevišķās valstīs.
Biolīdzinieki
Biolīdzinieki nav (un arī nevar būt) identiskas atsauces zāļu kopijas, tāpēc jārēķinās ar atšķirībām medikamenta farmakokinētikā; atšķirībām medikamenta farmakodinamikā jeb klīniskajā efektivitātē un to imunogenitāti. Vismaz insulīna preparātu gadījumā biolīdzinieku farmakokinētikai un farmakodinamikai pilnībā jāatbilst atsauces zālēm, turklāt šai salīdzināmībai jābūt atkārtojamai, jo pretējā gadījumā pieaugs pacientu proporcija ar slikti kompensētu cukura diabētu vai hipoglikēmijas epizožu skaitu. To var testēt tikai klīniskajos pētījumos. Pamācošs piemērs ir Marvel Lifesciences Private Limited ražotie biolīdzinieki: tā dati par vidēji ilgas darbības biolīdzinieka farmakokinētiku liecināja par bioekvivalenci, bet tā metabolais efekts (resp., spēja mazināt glikēmiju) bija par 27% mazāks (skat. attēlu).
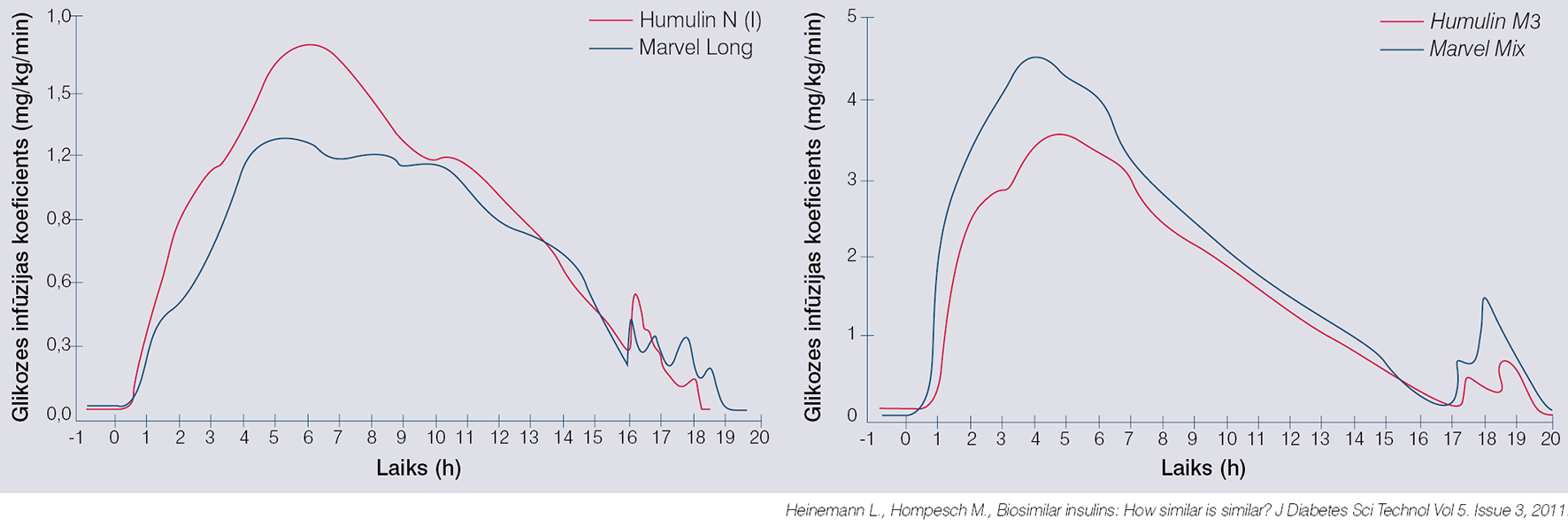

1. attēls
Farmakodinamiskās atšķirības starp atsauces zālēm un biolīdzinieku t.s. eiglikēmiskā glikozes kompensācijas testa laikā
Cits būtisks aspekts cukura diabēta pacientu aprūpē ir dzīves kvalitāte, tāpēc aktuāls ir jautājums arī par insulīna preparāta piedāvātajiem biolīdzinieka ievades tehniskajiem risinājumiem: šļirces, adatas, kasetnes, insulīna sūknis, tāpat ne mazāk svarīga ir sēriju nemainība un piegādes pastāvība, kā arī glabāšana. Arī biolīdziniekiem iespējama imunogenitāte, kas krasi var atšķirties no atsauces zālēm, jo to nosaka iespējamie piemaisījumi, pēctranslācijas modifikācijas saimniekšūnu ribosomās un ķīmiskie procesi, veidojot zāļu formu un to glabājot. Tā kā insulīna terapija ir ilgstoša (visu turpmāko dzīvi) un ar imūntoleranci saistītie B limfocītu funkcijas traucējumi var būt klīniski nozīmīgi, jāveido ilgstošas drošuma uzraudzības sistēmas. Tieši tāpēc endokrinoloģijā nav iespējama jau lietotu biozāļu automātiska aizvietošana, bet lēmums par ārstēšanu ar atsauces zālēm vai to biolīdzinieku atbilstīgi individuālajiem terapijas mērķiem jāpieņem ārstam, kas pacientu novēro ikdienā. Arī "Kompensējamo zāļu sarakstā" jāiekļauj norāde, ka attiecīgās zāles ir jau zināmu zāļu biolīdzinieks.
Biozāles onkoloģijā
Gadu desmitiem vēža medikamentozās terapijas pamatā bija sistēmiska mazmolekulāru citotoksisku ķīmijpreparātu lietošana. To darbības pamatā bija ātri dalošos šūnu proliferācijas nomākums, bloķējot replikācijas procesus un DNS spirāles veidošanos, pārraujot vai destabilizējot DNS saites, traucējot normālu mikrotubulu veidošanās procesu mitotiskās vārpstas izveides gaitā vai nomācot DNS replikācijai absolūti nepieciešamu nukleīnskābju sintēzi. Šo līdzekļu terapeitiskās darbības platums joprojām ir visai neliels un vairākumam pacientu attīstās pēc smaguma pakāpes atšķirīgas blaknes (visbiežāk alopēcija, gremošanas sistēmas traucējumi un mielosupresija), kas būtiski ietekmē pacientu līdzestību un iespējas pabeigt terapijas kursu.
Biozāļu lietošana, kuru onkoloģijā bieži dēvē par mērķterapiju (target-oriented therapy), saistīta ar šo vielu spēju selektīvi bloķēt specifiskās molekulas, kas nodrošina audzēja augšanu un attīstību. Dažas no šīm molekulām atrodamas arī veselās šūnās, taču audzēja audos vērojama to mutācija vai pārmērīga ekspresija. Mūsdienās mērķterapija aptver kā monoklonālo antivielu, tā arī mazmolekulāro inhibitoru lietošanu, tomēr šā dokumenta ietvaros sīkāk aplūkota tikai pirmā grupa.
Monoklonālo antivielu iedarbība uz audzēja šūnām iespējama vairākos veidos: ietekmējot organisma imūnsistēmas funkcijas (dabiskās galētājšūnas un komplementa kaskādi), piesaistoties mērķšūnai, saistoties ar ligandiem vai receptoriem un tādējādi bremzējot vai pat pilnībā pārtraucot vēža šūnu proliferāciju, vai arī pārnesot radioizotopus vai toksīnus uz mērķšūnām (t.s. konjugētās monoklonālās antivielas). Monoklonālās antivielas parasti ievada intravenozi, jo gremošanas traktā tās inaktivējas. Tās nemetabolizējas aknās, tāpēc nav sagaidāma to mijiedarbība ar citiem preparātiem. Monoklonālo antivielu izdales pusperiods ir visai ilgs, tāpēc tās var ordinēt ik pēc 1-4 nedēļām. To ieviešana pēdējā gadu desmitā kardināli mainījusi ārstēšanas iespējas pacientiem ar krūts, plaušu, aizkuņģa dziedzera un kolorektāliem audzējiem, limfomām, leikozēm un mielomas slimību. Šī terapija vērsta pret konkrēti nosakāmu molekulāro mērķi, kura esību ietekmē ne tikai audzēja bioloģiskie rādītāji, bet arī pacienta vecums, dzimums un etniskā piederība. Kaut gan mērķterapiju pacienti panes labāk nekā tradicionālo audzēju ķīmijterapiju un tā ir ērtāk lietojama, taču arī tai ir savas pēc smaguma pakāpes atšķirīgas blaknes, piemēram, aknei līdzīgi ādas izsitumi, sirdsdarbības traucējumi, tromboze, asiņošana, mielosupresija un hipertensija. Šobrīd vēl pāragri spriest par šo medikamentu ilgtermiņa ietekmi uz pacienta veselību. Turklāt jāņem vērā, ka vēža pacientiem slimības un terapijas iespaidā ir traucētas normālās imūnfunkcijas, kas papildus var ietekmēt mērķterapijas iedarbību.
Licenci pirmajai monoklonālajai antivielai FDA izsniedza 1986. gadā, un kopš tā laika radīts ap 20 jaunu molekulu, no kurām puse paredzēta vēža ārstēšanai. Pēdējos desmit gados nozīmīgi mainījušās monoklonālo antivielu ieguves tehnoloģijas, būtiski mazinot svešo (piem., peles) antivielu klātbūtni.
Mērķterapijas atsauces zāles ir DNS tehnoloģiju ceļā iegūti rekombinēti proteīni vai peptīdi, kas pēc uzbūves līdzīgi endogēniem hormoniem, citokīniem vai antivielām. Šo zāļu ražošana ir sarežģīts daudzpakāpju process, tāpēc biolīdzinieka gadījumā vienmēr iespējamas atkāpes no atsauces zālēm. Rezultātā jaunās zāles var būt līdzvērtīgas efektivitātes ziņā, bet to imunogenitāte un blakņu spektrs var atšķirties. Arī devu aprēķināšanas metodoloģija ir sarežģītāka, jo efektivitātes RECIST kritēriji var izrādīties nepietiekami. Tāpēc pētījumos ar biozālēm un to biolīdziniekiem iekļauj tādus farmakodinamiskos rādītājus kā audzēja metaboliskā aktivitāte, cirkulējošo audzēja un endotēlija šūnu skaits un mērķa molekulu skaits audzēja audos, savukārt tas krasi sadārdzina klīnisko izpēti.
Visas līdz šim onkoloģijā lietotās mērķterapijas zāles nosacīti var iedalīt divās grupās: līdzekļos, kam varētu būt potenciāli ārstējoša iedarbība (ietekmē dzīvildzi, no slimības brīvo periodu, mirstību), un līdzekļos, kas neietekmē slimības gaitu, bet mazina ar slimību un tās ārstēšanu saistītās komplikācijas un uzlabo dzīves kvalitāti (piem., mazina anēmijas vai febrīlas neitropēnijas risku). Turklāt vairākumā gadījumu mērķterapiju pagaidām ordinē kā papildinājumu standartterapijai vai kompleksi kopā ar citām balstterapijas metodēm.
Biolīdzinieku ienākšanai onkoloģijas praksē var būt vairāku veidu sekas: pirmkārt, jārēķinās, ka šo zāļu cenu samazinājums var nebūt tik liels kā ķīmiski sintezētiem preparātiem (piem., svārstīties tikai 20-30% apmērā); otrkārt, jārēķinās ar grūti prognozējamām blaknēm un ilgtermiņa efektivitāti; treškārt, kā šīs zāles, tā to atsauces zāles veidos tikai nelielu daļu no kopējās sistēmiskās audzēju medikamentozās terapijas un pilnībā neaizstās līdz šim lietotās standartterapijas un balstterapijas metodes. Apkopojumu par monoklonālajām antivielām un fūzijas proteīniem, ko izmanto vēža ārstēšanai, skat. 1. tabulā.
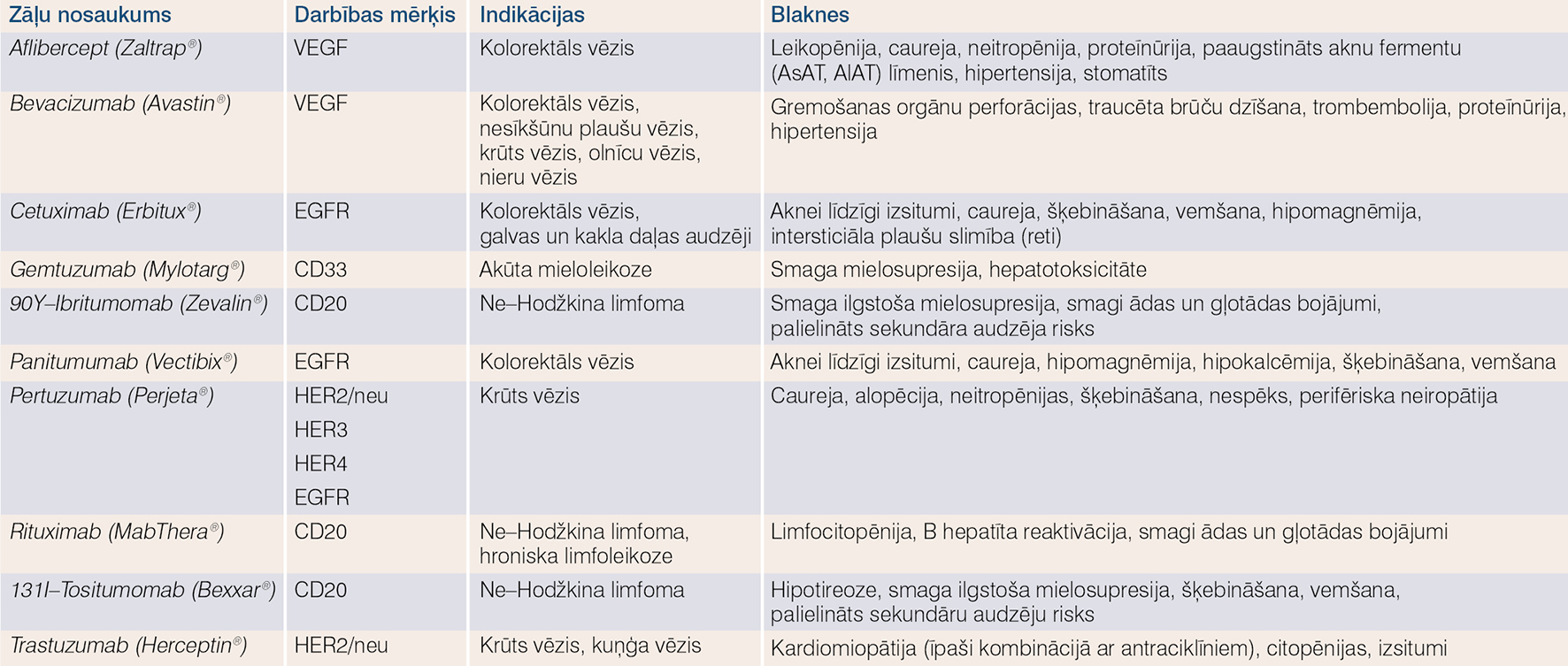

1. tabula
Monoklonālās antivielas un fūzijas proteīni vēža ārstēšanai
Biozāles bērnu reimatoloģijā
Biozāles bērnu reimatoloģijā izmanto autoimūno slimību, visplašāk juvenilā idiopātiska artrīta (JIA), ārstēšanā. JIA ir nezināmas etioloģijas hronisku artrītu grupa, kurā ietilpst septiņi slimības tipi. JIA terapijai ir jābūt agrīnai, efektīvai un drošai, lai mazinātu un nomāktu sinovītu un locītavu iekaisumu, novērstu locītavas skrimšļa un kaulu bojājumu attīstību; normalizētu locītavu funkcijas un nepieļautu invalidizāciju.
Pēc EMA un Amerikas Reimatologu kolēģijas (American College of Rheumatology, ACR) 2011. gada ieteikumiem JIA terapijas efektivitātes sasniegšanai izstrādāts ārstēšanas algoritms. Ja JIA terapija ar tradicionāliem slimību modificējošiem līdzekļiem (TSML) nav efektīva un pacientam konstatējami nelabvēlīgi prognozes faktori, JIA jāsāk ārstēt ar bioloģiskajiem slimību modificējošajiem līdzekļiem (BSML), resp. biozālēm. Biozāļu mērķmolekulas JIA gadījumā ir citokīni (TNF, IL-1, IL-6) vai virsmas antigēni (CD20, CD28).
Būtiskākās biozāļu grupas bērnu reimatoloģijā:
- monoklonālās antivielas - mab (Tocilizumab);
- šķīstošie receptori - cept (Etanercept);
- receptoru antagonisti - Anakinra (= IL-1RA).
BSML būtiski aizkavē kā locītavu, tā ekstraartikulāru sistēmisku (sirds un asinsvadu sistēmas, elpošanas sistēmas, nieru u.c.) bojājumu rašanos, tādējādi mazinot vai aizkavējot pacientu invalidizāciju un jūtami uzlabojot viņu dzīves kvalitāti. Pirms biozāļu ieviešanas JIA bija slimība ar smagu gaitu, kas nereti beidzās ar pacienta invalidizāciju, augšanas aizkavēšanos un redzes pavājināšanos.
Atšķirībā no TSML, piemēram, metotreksāta, BSML iedarbojas uz konkrētām slimības procesā iesaistītām imūnsistēmas daļām. Biozāles selektīvi inhibē galvenos iekaisumu un audu bojājumu mediatorus, tāpēc var apgalvot, ka to ieviešana klīniskajā praksē sākusi jaunu ēru šo slimību ārstēšanā. Tomēr biozāles nav alternatīva TSML, jo tie nepieciešami tikai pacientiem ar smagu un pret tradicionālo terapiju rezistentu slimības klīnisko gaitu.
Biozāles bērnu reimatoloģijā iedala vairākās grupās pēc to iedarbības uz endogēnajiem iekaisuma citokīniem vai molekulām:
- TNF-α (audzēju nekrozes faktoru) bloķējošie līdzekļi: Etanercept, Adalimumab, Infliximab, Golimumab, Certolizumab;
- T šūnu aktivācijas inhibitori: Abatacept;
- Monoklonālās antivielas pret interleikīniem:
- IL-6 receptoru antagonisti - Tocilizumab,
- IL-1 receptoru antagonisti - Anakinra, Canakinumab, Rilonacept.
JIA iekšējā heterogenitāte (dažādu slimības tipu gadījumā iesaistīti citi patofizioloģiskie mehānismi) ļauj izprast mainīgu dažādu biozāļu grupu efektivitāti. JIA gadījumā visbiežāk lietotā biozāļu grupa ir TNF-α inhibitori. Pēdējos desmit gados informācija par biozāļu lietojumu un pieredze par to lietošanas algoritmiem uzkrāta nejaušināta iedalījuma klīniskos pētījumos un ilgstošos beziejaukšanās pētījumos, apkopojot ilgtermiņa datus par to drošumu un efektivitāti. Ņemot vērā slimības neviendabīgumu, gadījumos, kad sākotnējā terapija bijusi neefektīva, terapija jāizvēlas atbilstīgi pierādījumiem, kas iegūti klīniskajos pētījumos. Tas ļauj atrast individualizētu pieeju katram pacientam atbilstīgi slimības klīniskajai gaitai, tās smagumam un ekstraartikulārajām slimības izpausmēm.
Biozāles pieaugušo reimatoloģijā
Daudzus gadu desmitus reimatisko slimību ārstēšanā visplašāk izmantoja sintētiskos slimību modificējošos antireimatiskos medikamentus (SMARM), kuru darbības pamatā ir imūnsistēmas nomākums. Daudziem pacientiem šo medikamentu kombinācijas bija neefektīvas, nereti attīstījās nopietnas blaknes. Biozāļu ieviešana pieaugušo reimatisko slimību ārstēšanā būtiski mainījusi slimības gaitu pacientiem, kam sintētiskie SMARM bija neefektīvi. Šīs zāles mērķtiecīgi darbojas pret iekaisuma citokīniem, šūnu aktivāciju un iekaisuma gēnu transkripciju, kas ir būtiski locītavu iekaisuma uzturēšanā. Biozāles, kuru efektivitāte pierādīta daudzu reimatisko slimību terapijā, sākotnēji lietoja galvenokārt reimatoīdā artrīta, ankilozējošā spondiloartrīta un psoriātiska artrīta ārstēšanā, bet tagad tās izmanto arī sistēmiskās sarkanās vilkēdes un atsevišķu vaskulīta formu gadījumā. Tās būtiski mazina slimības simptomus, veicina remisijas sasniegšanu un novērš slimības progresiju, uzlabojot pacienta funkcionālo stāvokli un dzīves kvalitāti un attālinot invaliditātes iestāšanos. Remisijas sasniegšana novērš arī viscerālo bojājumu rašanos, tādējādi ietekmējot dzīvildzi.
Reimatisko slimību ārstēšanā pieaugušajiem biozāles lieto aktīvas un agresīvas slimības gadījumā, katras slimības gadījumā izstrādāts algoritms, kad būtu jāsāk to lietošana. Pašreiz visplašāk izmanto TNF-α inhibitorus (Adalimumab, Etanercept, Infliximab, Golimumab, Certolizumab pegol), interleikīna-6 receptora inhibitoru Tocilizumab, CD20 monoklonālās antivielas Rituximab, T šūnu kostimulācijas modulatoru Abatacept, interleikīna-1 receptora inhibitoru Anakinra un B limfocītu stimulatora monoklonālās antivielas Belimumab.
Izvēloties biozāles pieaugušo reimatisko slimību ārstēšanā, jāņem vērā trīs problēmas aspekti:
- standartterapijas neefektivitātes gadījumā jāievēro stingras indikācijas saskaņā ar terapijas algoritmu (katras slimības gadījumā vērtējot tās aktivitāti pēc starptautiski izstrādātiem kritērijiem);
- rūpīga drošuma protokola ievērošana;
- individualizēta pieeja katram pacientam ar mērķi sasniegt objektīvu remisiju.
Turklāt allaž jāņem vērā kā dažādu grupu biozāļu farmakokinētikas atšķirības, tā atšķirības vienas grupas ietvaros un individuālās īpatnības (saistībā, piemēram, ar taukaudu imūnmodulējošām īpašībām, enzīmu aktivitāti, gēnu ekspresiju). Biozāļu klāstam jābūt līdzsvarotam ne vien no izmaksu, bet arī no efektivitātes un drošuma aspektiem, saglabājot pacientu darbaspējas un novēršot invalidizāciju. Lai ordinētu biozāles valsts kompensācijas ietvaros, Latvijā nepieciešams pozitīvs reimatologu konsilija lēmums katrā individuālā gadījumā.
Biozāles neiroloģijā
Visplašāk biozāles neiroloģijā izmanto multiplās sklerozes (MS) ārstēšanā. Klīniskajos pētījumos iegūti pierādījumi, ka noteikti medikamenti var mainīt MS slimības gaitu, samazinot uzliesmojumu biežumu un demielinizējošu perēkļu skaitu magnētiskās rezonanses izmeklējumā. Šādas modificējošas terapijas mērķis ir mazināt uzliesmojumu skaitu un attālināt invaliditātes attīstību. Pierādīts, ka pat agrīnās MS stadijās veidojas aksonāls nervu šķiedru bojājums, kas rada neatgriezenisku invalidizāciju, tāpēc terapija ar slimību modificējošām zālēm jāsāk iespējami agrīni.Vislielākā pieredze uzkrāta ar bēta-1a interferoniem (skat. 2. tabulu), ko MS ārstēšanā lieto vairāk nekā 20 gadu. Pagaidām nav medikamentu, kas varētu pilnībā izārstēt MS, tomēr interferoni var būtiski ietekmēt slimības gaitu. Interferoni ir endogēnu glikoproteīnu grupa, kam ir imūnmodulējošas, pretvīrusu un antiproliferatīvas īpašības. Interferonu darbības mehānisms MS gadījumā nav pilnībā izprasts. Uzskata, ka tie ietekmē T šūnu aktivāciju, inhibē iekaisuma citokīnu produkciju, veicina pretiekaisuma citokīnu produkciju, aktivē T nomācējšūnas, mazina hematoencefaliskās barjeras caurlaidības pārmaiņas, kavē T šūnu infiltrāciju centrālajā nervu sistēmā. Šim terapijas veidam raksturīgas specifiskas blaknes (gripai līdzīgi simptomi ar drudzi; muskuļu un locītavu sāpes, reakcija injekcijas vietā, depresija, pārmaiņas asinsainā u.c.), kas parasti izzūd 1-3 mēnešos. Lai izvairītos no blaknēm, zāļu devu pielāgo pakāpeniski, lieto nesteroīdos pretiekaisuma līdzekļus, injicē ar pilnšļircēm. Terapijas efektu izvērtē, nosakot antivielu līmeni pret interferonu, jo specifiskās neitralizējošās antivielas, kas veidojas terapijas laikā, var mazināt tās efektivitāti. Antivielu titru nosaka pirms specifiskās terapijas un ik pēc trim mēnešiem.
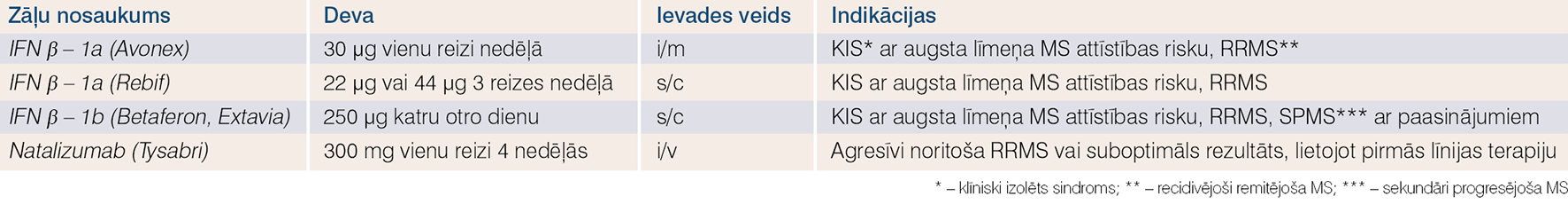

2. tabula
Biežāk lietotās biozāles multiplās sklerozes ārstēšanā
ES apstiprināti trīs ar rekombinētās DNS tehnoloģijas palīdzību ražoti bēta interferona medikamenti kā pirmās kārtas terapija MS ārstēšanā. Tie atšķiras pēc molekulas struktūras, ievades veida, devas un indikācijām. EMA izstrādājusi vadlīnijas bēta interferonu saturošu biolīdzinieku reģistrācijai - EMA/CHMP/BMWP/652000/2010, tajās atspoguļots pašreizējais viedoklis par neklīniskām un klīniskām prasībām rekombinēto bēta interferonu saturošu zāļu efektivitātes un drošuma salīdzināšanai.
Pamatziņas par biozālēm
- Biozāles tiek ražotas, izmantojot modernās biotehnoloģijas metodes, tāpēc to molekulas ir lielāka izmēra un daudz sarežģītākas pēc struktūras nekā ķīmiskā ceļā sintezēto zāļu molekulas.
- Biozāles apstiprina EMA centrālās reģistrācijas procedūrā.
- Biolīdzinieku reģistrācijas procesā netiek pieprasīti klīniskie dati visās indikācijās, kurās apstiprinātas atsauces biozāles, tāpēc notiek indikāciju ekstrapolācija.
- Biozales spēj izraisīt imūnatbildi (imunogenitāte), tāpēc nepieciešami papildu farmakovigilances pasākumi riska pārvaldības plānu ietvaros.
- Ir būtiskas atšķirības starp biolīdziniekiem un ģenēriskām zālēm, kas jāņem vērā, vērtējot to aizstājamību un drošumu.
- Biozāļu uzbūves īpatnību dēļ nav pieļaujama to automātiska aizvietošana aptiekā, bet šāda lēmuma pieņemšana jāatstāj ārstējošā ārsta ziņā.