Miokarda bojājuma (nekrozes) bioķīmiskie marķieri
Laboratorie izmeklējumi, ko standartā iesaka veikt pacientiem ar AKS:
- miokarda bojājuma (nekrozes) bioķīmiskie marķieri (MBBM);
- leikocītu skaits, formula un trombocīti;
- INR (specifisks koagulācijas līmeni nosakošs koeficients, norma ir 1);
- APTL (aktivētais tromboplastīna laiks);
- elektrolītu līmenis (kālijs, magnijs);
- kreatinīns, glomeruļu filtrācijas ātrums;
- glikozes līmenis;
- CRO (Creaktīvais olbaltums);
- seruma lipīdi (KH, ZBLH, ABLH, TG).
Miokarda bojājumu išēmijas gadījumā vislabāk var novērtēt, nosakot asinīs miokarda proteīnus. Galvenie proteīni, kas nokļūst asinīs miocītu bojājuma gadījumā, ir troponīns T un I, kreatinīnkināze (CK), kreatinīnkināzes MB frakcijas (CK-MB) mioglobulīns, laktātdehidrogenāze u.c.
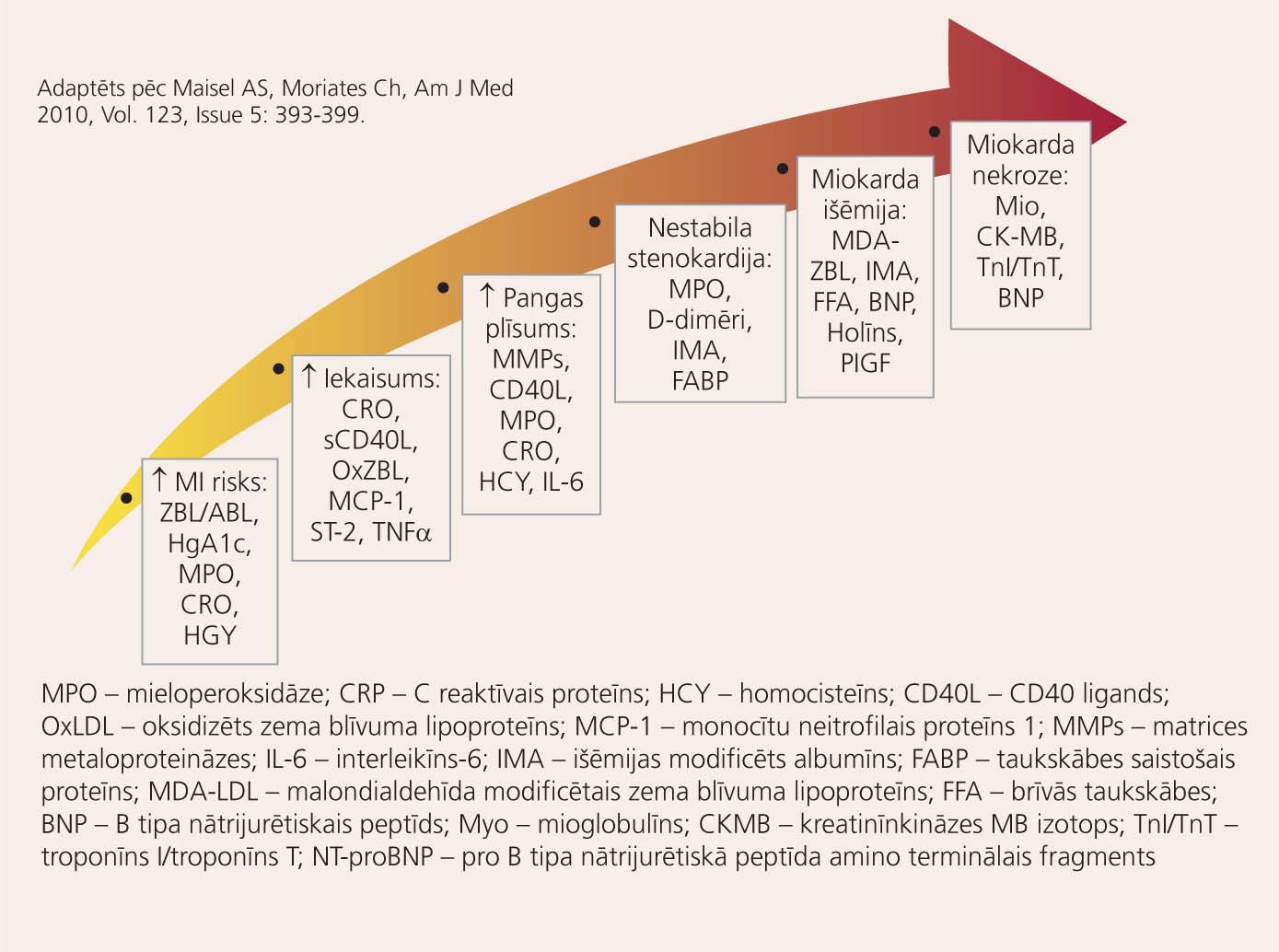

1. attēls
Svarīgākie bioloģiskie marķieri, kas spēj sniegt palīdzību koronārās sirds slimības dažādu stadiju diagnostikā un prognozes noteikšanā
Troponīna palielināšanās asinīs norāda uz miokarda bojājumu, bet nenorāda uz mehānismu; tā var būt miokardīta, smagas sirds mazspējas, plaušu trombembolijas u. c. gadījumos. [1]
Svarīgākie bioloģiskie marķieri, kas spēj sniegt palīdzību koronārās sirds slimības dažādu stadiju diagnostikā un prognozes noteikšanā apkopoti 1. attēlā.
Katram bioķīmiskajam marķierim ir savs specifiskums, jutīgums un līmeņa paaugstināšanās ātrums un ilgums (skat. 2. attēlu un 1. tabulu).
Sirds troponīns I un T
Sirds troponīnam (I vai T) ir praktiski absolūts miokarda audu specifiskums un ļoti augsta (visaugstākā) jutība. Pieņemts, ka jebkura sirds troponīnu T vai I palielināšanās norāda uz neatgriezenisku miokarda šūnu nekrozi. Troponīna līmeņa paaugstināšanās norāda pat uz niecīgiem miokarda bojājumiem. Nepietiek, ja troponīnu līmeni nosaka slimības sākumā, jo, piemēram, pirmajā stundā tas ir palielināts tikai 10-15% gadījumu. Troponīnu līmenis sāk paaugstināties pēc 3-4 stundām, maksimumu sasniedzot pēc 24 stundām. Ja sūdzību sākumā vai pirmajās 3-4 stundās pēc to sākuma troponīna līmenis nav paaugstināts, pēc 6-12 stundām nepieciešams veikt atkārtotu analīzi. Tā kā troponīns turas paaugstināts 5-10 dienas, tā izmantošana recidivējošas nekrozes diagnostikā ir ierobežota.
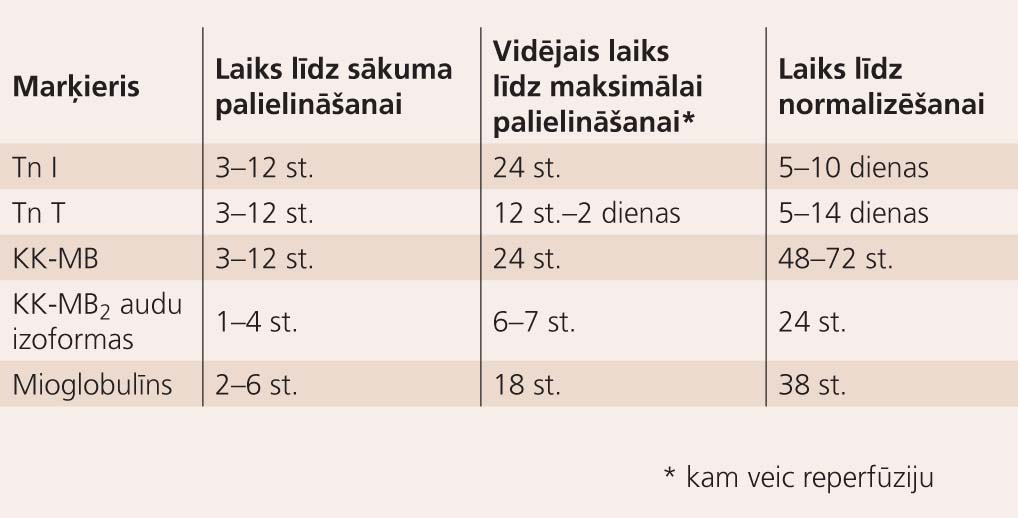

1. tabula
Galvenie miokarda nekrozes bioķīmiskie marķieri
Par robežu, kas varētu norādīt uz miokarda bojājumu, uzskata troponīna I līmeni 0,8-1 ng/ml. 1-2 ng/ml norāda uz iniciālu nekrozi, bet vairāk par 2 ng/ml varētu būt MI robežlielums. Jāatzīmē, ka šie robežlielumi dažādās laboratorijās var atšķirties. [1]
Sirds troponīna līmenis ir atkarīgs no bojājuma apjoma (infarkta izmēriem), kas ļauj klīnicistiem izvērtēt iespējamo prognozi, diemžēl pēc reperfūzijas terapijas aktuālais troponīna līmenis var būt maldinošs washout fenomena dēļ. Troponīna līmenis maksimumu sasniedz 12. stundā un var saglabāties paaugstināts līdz pat 10 dienām. Lai gan troponīna izmantošana AMI diagnostikā un riska noteikšanā ir ievērojami uzlabojusi iespējas palīdzēt šai sarežģītajai pacientu grupai, "gaidīšanas laiks" paliek šā biomarķiera Ahilleja papēdis. Moderna, jutīgāka troponīna noteikšana ļauj uzlabot šo vājo vietu, pozitīvs troponīna tests ir saistīts ar prognostiski nelabvēlīgu iznākumu 30 dienu laikā (HR 1,96; p=0,003).
Mioglobulīns
Mioglobulīns atrodas miokarda šūnās, bet arī citur (muskuļos), tāpēc tas nav specifisks marķieris, tomēr negatīva testa gadījumā tam ir augsta informativitāte. Mioglobulīns ir ļoti jutīgs bojājuma marķieris, tas parādās jau minimālu bojājumu gadījumā. Testa priekšrocība un trūkums ir ļoti ātra atrade (jau nekrozes pirmajās stundās), kā arī ātra normalizācija, tāpēc to var izmantot agrīnai nekrozes noteikšanai, kā arī recidivējošu nekrožu diagnostikā. [3]
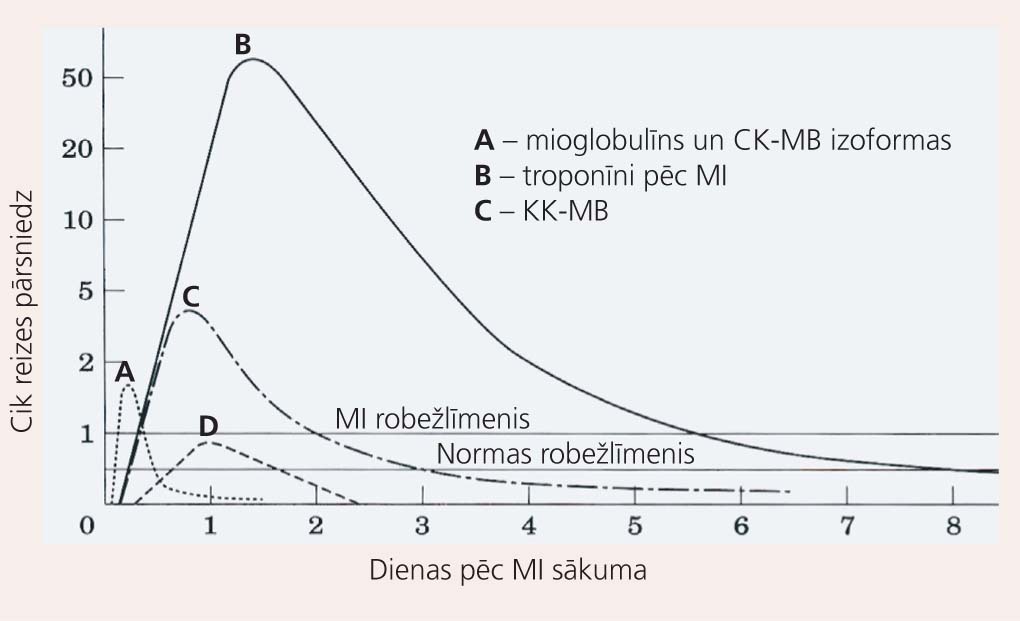

2. attēls
MI marķieru dinamika
Kreatinīnkināzes MB frakcijas (KK-MB)
Kreatinīnkināzes MB frakcijas (KK-MB) izoformas, īpaši KK-MB2 noteikšana ir jutīgs un specifisks MBBM. Agrīns MI marķie ris ir kardiālās izoformas palielināšanās (KK-MB2 > 1 vien./l) vai palielināta attiecība KK-MB2 : KK-MB1 > 1,5. KK-MB frakcijas izoformas palielinās pirmo 6 stundu laikā no MI sākuma, bet troponīni ir vēlīnāks marķieris, tāpēc labāka un drošāka ir abu marķieru vienlaicīga noteikšana. Tā kā troponīnu līmeņa paaugstināšanās ir jutīgāka nekā KK-MB frakcijas palielināšanās, apmēram vienai trešdaļai pacientu ar AKS novēro tikai troponīnu palielināšanos bez KK-MB palielināšanās. Ja pacientam ir stenokardijas tipa sāpes un nav palielināta KK-MB, bet ir pozitīvi troponīnu rādītāji, jādomā par nelielu miokarda nekrozi (mikroinfarktu). Kopējās KK noteikšanai ir maza nozīme MI diagnostikā mazā specifiskuma dēļ. [3]
Glutamīnoksaletiķskābes transamināze (AsAT), laktātdehidrogenāze (LDH) un tās izoenzīmi nav izmantojami miokarda bojājumu diagnostikā. 3. attēlā redzama dažādu patoloģisko procesu marķieru saistība ar akūtu miokarda infarktu.
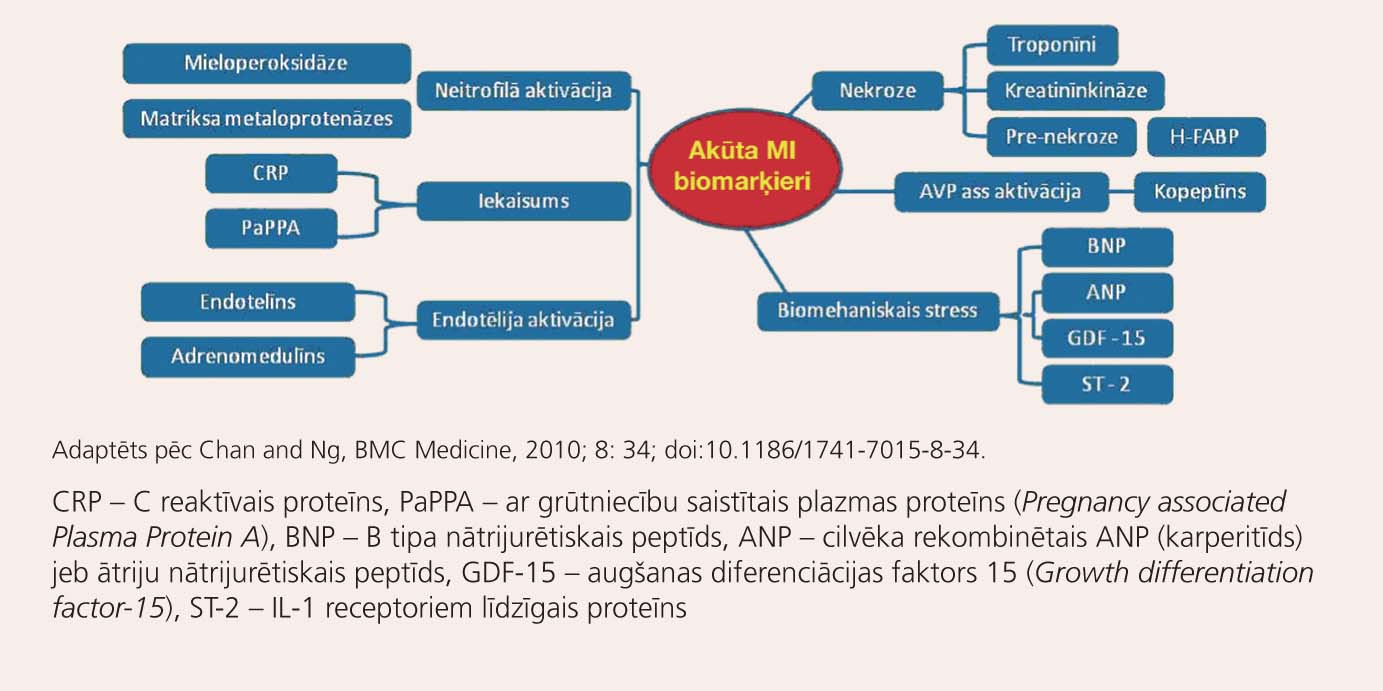

3. attēls
Dažādu patofizioloģisko procesu marķieru saistība ar akūtu miokarda infarktu
C termināla vazopresīns (kopeptīns)
Kopeptīns ir viens no stabilākajiem arginīna vazopresīna (AVP) aizstājējiem ar labi izpētītu efektu un osmoregulāciju un kardiovaskulāro homeostāzi. Pēc MI vazopresīns sekmē perifēro vazokonstriktoru aktivitāti, tādējādi paaugstinot pēcslodzi un kambaru stresu. Paaugstināta proteīnu sintēze miocītos sekmē hipertrofijas attīstību un koronāro artēriju vazokonstrikciju. Šos efektus nodrošina V1 tipa receptori, kamēr V2 receptoru efekti ietekmē šķidruma aizturi nieru tubuļos. Ietekme uz šiem receptoriem šobrīd ir viens no farmakoloģijas zinātnes mērķiem. Kopeptīns izdalās stoihometriskās proporcijās, ir stabils un vienkārši nosakāms. [5]
Kopeptīns nosaka MI pazīmes agrāk, salīdzinot ar negatīvu troponīnu T. Kopeptīna līmenis zem 14 pg/ml un troponīna T līmenis zem 0,01 ļauj neapstiprināt MI diagnozi, un tas ļauj izvairīties no monitorēšanas un ilgstošiem atkārtotiem testiem lielai daļai pacientu. Kopeptīns ir labs neirohormonālā stresa marķieris, var tikt izmantots riska noteikšanā sepses pacientiem, kā arī saistībā ar citām klīniskām situācijām, tāpēc to nevar uzskatīt par augsti specifisku sirds-asinsvadu sistēmas patoloģijām. [5]
Sirds tipa ar taukskābēm saistošais proteīns
Sirds tipa ar taukskābēm saistošais proteīns (Heart-Type Fatty Acid Binding Protein (H-FABP)) ir zemas molekulārās masas proteīns, kas piedalās miokarda taukskābju metabolismā. [7] Nelielā daudzumā sastopams smadzenēs, nieru un skeleta audos, līmenis pieaug akūta išēmiska insulta un intensīvas slodzes gadījumos. Miokarda infarkta un nekrozes gadījumā ātri tiek izdalīts citosolā. Literatūrā H-FABP tiek minēts kā agrīns išēmijas marķieris pirms morfoloģiskām miokarda nekrotiskajām izmaiņām un ļauj apstiprināt miokarda infarkta diagnozi agrāk. [8] Diemžēl klīniskie pētījumi nav apliecinājuši H-FABP kā vienas specifiskas pazīmes informativitāti. Pozitīvi, apliecinoši un ar citiem izmeklējumiem apliecinoši dati iegūti 65,8% gadījumu, bet negatīvi dati 82% pēc Body meta-analīzes datiem. [9] Tajā pašā laikā H-FABP pieaugums saistāms ar mirstības, miokarda infarkta un sirds mazspējas pieaugumu 10 mēnešu laikā. Proteīna līmenim pieaugot pēc akūta koronāra sindroma, augstākie radītāji, kas sadala 4 kvantitatīvajos līmeņos, saistās ar 6,59 reizes augstāku visu veidu mirstību. [9] Negatīvs troponīna testa līmenis plus H-FABP līmenis zem 5,8 mcg/ l saistāms ar 0% mirstību 6 mēnešu laikā, negatīvs troponīns plus H-FABP >5,8 mcg/l saistāms ar 4,93 reižu mirstības riska pieaugumu, savukārt, ja troponīns ir pozitīvs un H-FABP ir > 5,8 mcg/l, tad mirstības risks pieaug par 7,93 reizēm. [10; 11]
Prognostiskie bioloģiskie marķieri
Biomehaniskā stresa marķieri
BNP un NTproBNP
Plašāk zināmais biomehāniskā stresa marķieris ir B tipa nātrijurētiskais peptīds (literatūrā ierasti sastopama abreviatūra BNP). Sekretēts kambaros atbilstīgi kardiomiocītu iestiepumam. Saistās un aktivē receptorus, lai reducētu vaskulāro rezistenci, centrālā venozā spiediena un nātrijurēzes pieaugumu.
Informativitāte ir augsta, taču jāatzīmē, ka BNP līmeni ietekmē dažādi faktori. Arī atšķirīga vecuma pacientiem BNP līmeņa informativitāte atšķiras.
Nātrijurētiskie peptīdi
Laboratorijas testos var iegūt pietiekami daudz informācijas par sirds mazspējas diagnozi, taču viens no mūsdienu diagnostiskajiem marķieriem ir kambara sienu iestiepuma/stresa marķieris jeb nātrijurētiskais peptīds (BNP - brain natriuretic peptide) (> 400 pg/ml) NT-proBNP > 2000 pg/ml. Normas skatāmas 2. tabulā. Nereti ir vairāki kritēriji, kas it kā liecina par sirds mazspēju - elpas trūkums, nespēks, nogurums, taču BNP ir normas robežās. Tādos gadījumos diagnostikas skatam jāvēršas plašāk, jo elpas trūkumam pie slodzes var būt 1001 iemesls - un nebūt ne lielākā daļa no tiem saistīti ar sirds mazspēju. [1]
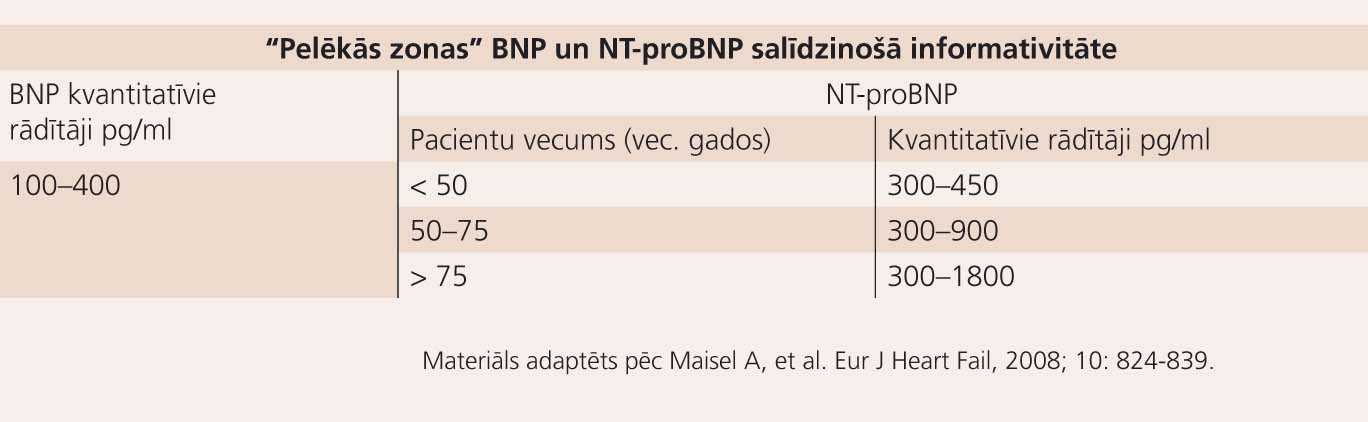

2. tabula
BNP un NT–proBNP normas
Nātrijurētiskais peptīds ir peptīdu saimes peptīds, ko veido 17 aminoskābju gredzens, kas kopā saistīts ar disulfīdu saitēm, bet tie ir ģenētiski atšķirīgi, tāpēc arī to darbība kardiovaskulārajā sistēmā, nierēs un endokrīnajā sistēmā atšķiras. Cilvēkiem nātrijurētiskā peptīdu saime sastāv no atriālā nātrijurētiskā peptīda (ANP), smadzeņu nātrijurētiskā peptīda (BNP), kas cēlies no miokardiālām šūnām, C tipa nātrijurētiskā peptīda (CNP) ar endoteliālu izcelsmi un urodilatīna (Uro), kas, domājams, cēlies no nierēm (skat. 5. attēlu). Turklāt nātrijurētiskie peptīdi atrasti arī citiem mugurkaulniekiem. Daži tika atrasti čūsku indēs: Dendroaspis angusticeps nātrijurētiskie peptīdi tika atrasti Dendroaspis angusticeps (zaļās mambas) indē. CNP analogi tika klonēti no Crotalinae saimes čūskas indes dziedzera; Pseudocerastes persicus nātrijurētiskie peptīdi tika izolēti no Irānas Pseudocerastespersicus čūskas, bet trīs nātrijurētiskā tipa peptīdi (TNP-a, TNP-b un TNP-c) tika iegūti no Oxyuranus microlepidotus indes. [3]
Cilvēka rekombinētais ANP (karperitīds) klīniskajā praksē Japānā kopš 1995. gada tiek lietots akūtas, dekompensētas kongestīvas sirds mazspējas (KSM) ārstēšanai, cilvēka rekombinētais BNP (neseritīds) ar tādiem pašiem klīniskiem pamatojumiem kopš 2001. gada apstiprināts ASV Pārtikas un medikamentu pārvaldē (FDA), bet cilvēka rekombinētais Uro (ularitīds) pašlaik ir Eiropas klīnisko izmeklējumu III fāzē. [2]
Gan BNP, gan NT-preBNP tiek izmantoti kā biomarķieri, lai palīdzētu klīniski noteikt sirds mazspējas diagnozi, novērtēt sirds mazspējas smaguma pakāpi un sadalīt riska pakāpēs pacientus ar koronāro artēriju slimībām.
Nātrijurētisko peptīdu fizioloģiskās īpašības
ANP, BNP un Uro piesaistās nātrijurētiskā peptīda A receptoram (NPR-A), kas caur 3',5'-ciklisko guanozīna monofosfātu (cGMF) darbojas kā starpnieks nātrijurēzē, vazodilatācijā, renīna inhibīcijā, mitozes apturēšanā un pozitīvā lusitropismā. CNP trūkst nātrijurētiskās iedarbības, bet tas ierosina vazodilatāciju un augšanas inhibīciju caur guanilciklāzes nātrijurētiskā peptīda B receptoru (NPR-B). Visi četri peptīdi atbrīvoti ar nātrijurētiskā peptīda C receptoru (NPR-C) un sašķelti ar ektoenzīma neitrālo endopeptidāzi 24.11 (NEP), kas abi plaši tiek noteikti nierēs, plaušās un asinsvadu sienās. [3] Nātrijurētiskā peptīda receptora struktūru un signālu pārvades mehānismu skat. 6. attēlā.
Endogēnā nātrijurētiskā peptīda funkcionālā loma kardiorenālajā homeostāzē
Ar ģenētiski pārveidotu peļu palīdzību, kam tika vai nu izmainīta ANP ražošana, vai pārtraukta NPR-A receptoru sintēze (kas saista ANP un BNP), ir noskaidrota endogēnā nātrijurētiskā peptīda loma kardiorenālajā homeostāzē. Pēdējās desmitgadēs klīniskajos un eksperimentālajos pētījumos parādījusies vienota sapratne par nātrijurētisko peptīdu sistēmas nepieciešamību kardiovaskulārajā un nieru homeostāzē. Tieši nātrijurētisko peptīdu sistēmas ģenētiskā modifikācija ir devusi rezultātus, ārstējot tādus smagus klīniskos stāvokļus kā atsevišķu tipu rezistentas hipertensijas, samazinātas nieru reakcijas uz akūtu apjoma palielināšanos, kambaru hipertrofijas un pēkšņu nāvi. [1]
Ir ļoti svarīga sakarība starp nātrijurētisko peptīdu un cilvēka hipertensiju, tāpēc tika veikti pētījumi, kas parādīja, ka cilvēka ANP gēnā otrajā intronā ir restrikcijas fragmenta garuma polimorfisms; kandidātgēns ar līdzīgu uzņēmību pret hipertensiju un kurā arī ir restrikcijas fragmenta garuma polimorfisms ANP gēna lokusā hipertensijas vietā saistās ar primāro aldosteronu. Japāņu zinātnieks Tamura pierādījis, ka BNP gēna izgriešanas modelī par spīti normālajai hemodinamikai pelēm attīstās nozīmīga kambaru fibroze. Tālākie eksperimentālie farmakoloģiskie pētījumi ar NPR-A/B receptora antagonizēšanu rāda, ka endogēnajam nātrijurētiskajam peptīdam ir vazodilatējošas, nātrijurētiskas, diurētiskas, lusitropās un renīnu inhibējošas spējas, tas viss ir nepieciešams, lai saglabātu homeostāzi pie hroniskas sirds mazspējas. [3]
Eksperimentāli tika noskaidrots, ka pāreju no vidēji smagas sirds mazspējas uz smagu sirds mazspēju var paātrināt, izmantojot nātrijurētisko peptīdu receptoru antagonistus, kā rezultātā notika priekšlaicīga nātrija aizture un tika sabojāta nieru nātrijurētiskā atbilde uz tilpuma palielināšanos, parādījās traucējumi renīna-angiotenzīna-aldosterona sistēmā ar sekojošu sirds pildījuma spiediena palielināšanos. [3]
Eksogēnā nātrijurētiskā peptīda fizioloģiskās īpašības
Kopš pagrieziena punkta, kad 1981. gadā de Bold žurkām injicēja daļēji attīrītu žurku priekškambara ekstraktu, ir bijuši daudzi pētījumi par eksogēni ievadītā nātrijurētiskā peptīda fizioloģiskajām īpašībām. Sākotnējie pētījumi ar eksogēno nātrijurētisko peptīdu (ENP) sakrīt ar de Bolda novērojumiem, kas pierāda ENP spēju izraisīt vazodilatāciju un samazināt sirds pildījuma spiedienu, nātrijurēzi, diurēzi, palielinot nieru asins plūsmu, palielināt glomeruļu filtrācijas ātrumu, renīna supresiju.
Tālākie pētījumi par BNP un UroNP pierādījuši, ka tiem ir līdzīgas īpašības kā ENP. Citi mazāk zināmie, bet ļoti svarīgie nātrijurētisko peptīdu fizioloģiskie efekti ir prolusitorpīna simpatoinhibīcija, antiproliferatīvas, antiišēmiskas un pretiekaisuma īpašības. [2]