Akūta koronāra sindroma (AKS) pacientiem, kā zināms, ir paaugstināts pēkšņas kardiālas nāves risks, tādēļ svarīgi atpazīt tipiskas ar miokarda išēmiju saistītas sūdzības, lai savlaicīgi veiktu nepieciešamos papildizmeklējumus, precizētu diagnozi un sniegtu neatliekamu palīdzību. Akūta koronāra sindroma diagnozes uzstādīšanā ir svarīgi trīs parametri: klīniskā aina, izmaiņas elektrokardiogrammā (EKG) un miokarda bojājuma bioķīmiskie marķieri, ko nosaka asins paraugā. Šie parametri lielā mērā ietekmē arī tālāko ārstēšanas taktiku. Bet vai izmaiņas EKG un miokarda bojājuma bioķīmiskie marķieri ir vienīgie, kam ir nozīmīga loma pacienta riska novērtēšanā? Šī raksta mērķis pievērst uzmanību arī citiem asins analīzēs nosakāmiem parametriem, kas atspoguļo pacienta vispārējo stāvokli un prognozi, kā arī ļauj izvēlēties piemērotāko ārstēšanas taktiku.
Visiem pacientiem, kas stacionēti ar akūta koronāra sindroma (ar vai bez ST segmenta elevācijām) diagnozi, jau sākotnēji veicamas šādas analīzes: pilna asins aina (Er, Hb, Ht, Leu, Tr, EGĀ), koagulogramma (APTL, INR), fibrinogēns, bioķīmiskās asins analīzes (ALAT, ASAT, glikoze, urea, kreatinīns, kālijs, magnijs, miokarda bojājuma bioķīmiskie marķieri, kopējais holesterīns un tā frakcijas). Akūta koronāra sindroma vadlīnijas iesaka noteikt arī C reaktīvā proteīna lielumu. Atkarībā no blakusslimībām pacientam veic arī citas analīzes.
![Miokarda bojājuma bioķīmisko marķieru paaugstināšanās laiks [1]](https://cdn.doctus.lv/media/2011/09/2/original/b742fa2d65ce.jpg)
![Miokarda bojājuma bioķīmisko marķieru paaugstināšanās laiks [1]](https://cdn.doctus.lv/media/2011/09/2/original/b742fa2d65ce.jpg)
1. tabula
Miokarda bojājuma bioķīmisko marķieru paaugstināšanās laiks [1]
Miokarda bojājuma bioķīmiskie marķieri
Miocītu bojājumu išēmijas gadījumā vislabāk atspoguļo miokarda proteīnu (troponīnu I un T, kreatīnkināzes, krea tīnkināzes MB masas, mioglobīna) līmeņa paaugstināšanās asinīs.
Miokarda bojājuma bioķīmisko marķieru paaugstināšanās asinīs norāda uz miokarda bojājumu, taču neatklāj tā mehānismu. [1] Miokarda bojājuma marķieru paaugstināšanās ļauj diferencēt nestabilu stenokardiju no miokarda infarkta, jo sāpju raksturs abos gadījumos ir līdzīgs (vairāk atšķiras sāpju intensitāte un ilgums). Ļoti svarīgi noteikt miokarda bojājuma marķierus, ja pastāv aizdomas par akūtu koronāru sindromu cukura diabēta pacientiem, sievietēm, pacientiem, kas vecāki par 75 gadiem, un gados jauniem cilvēkiem (25-40 gadu vecumā), kam biežāk novēro atipisku klīniku. Diabēta pacientiem autonomās neiropātijas dēļ bieži vien ir nelielas intensitātes sāpes vai arī to vispār nav, līdz ar to par miokarda bojājumu galvenokārt var spriest pēc EKG un miokarda bojājuma marķieru dinamikas. EKG izmaiņas, kas liecina par išēmiju, ir sekojošas:
- ST segmenta elevācijas,
- ST segmenta depresijas,
- Hisa kūlīša kreisās kājiņas pilna blokāde, ja tā nav bijusi jau iepriekš,
- T zobu inversija,
- Q zoba veidošanās. [1]
Aptuveni 38% pacientu ar akūtu koronāru sindromu izmaiņas elektrokardiogrammā nekonstatē [1], tādēļ šajos gadījumos bez klīniskās ainas liela nozīme ir miokarda bojājuma marķieriem un to līmenim dinamikā.
Ja pirmie miokarda bojājuma marķieri ir negatīvi, tos noteikti atkārtoti jānosaka pēc 6-12 stundām. Miokarda bojājuma bioķīmisko marķieru atbrīvošanās laiks atspoguļots 1. tabulā.
Troponīni
Katram miokarda bojājuma bioķīmiskajam marķierim ir savs specifiskums un jutība. Visaugstākā jutība un praktiski absolūts miokarda audu specifiskums piemīt troponīniem. Pieņemts uzskatīt, ka troponīnu T un I palielināšanās norāda uz neatgriezenisku miokarda šūnu nekrozi. Pacientiem ar miokarda infarktu paaugstināts troponīnu līmenis perifērajās asinīs parādās aptuveni pēc trim, četrām stundām no klīnikas sākuma, maksimumu sasniedzot pēc 24 stundām. Tas var saglabāties paaugstināts līdz divām nedēļām. Akūta koronāra sindroma bez ST segmenta elevācijām gadījumā troponīnu līmenis var būt paaugstināts tikai 48-72 stundas. Šobrīd par miokarda infarkta recidīva kritēriju tiek uzskatīts arī troponīna pieaugums > 20% no līmeņa, kas fiksēts atkārtotu koronāru sāpju epizodes laikā. [2]
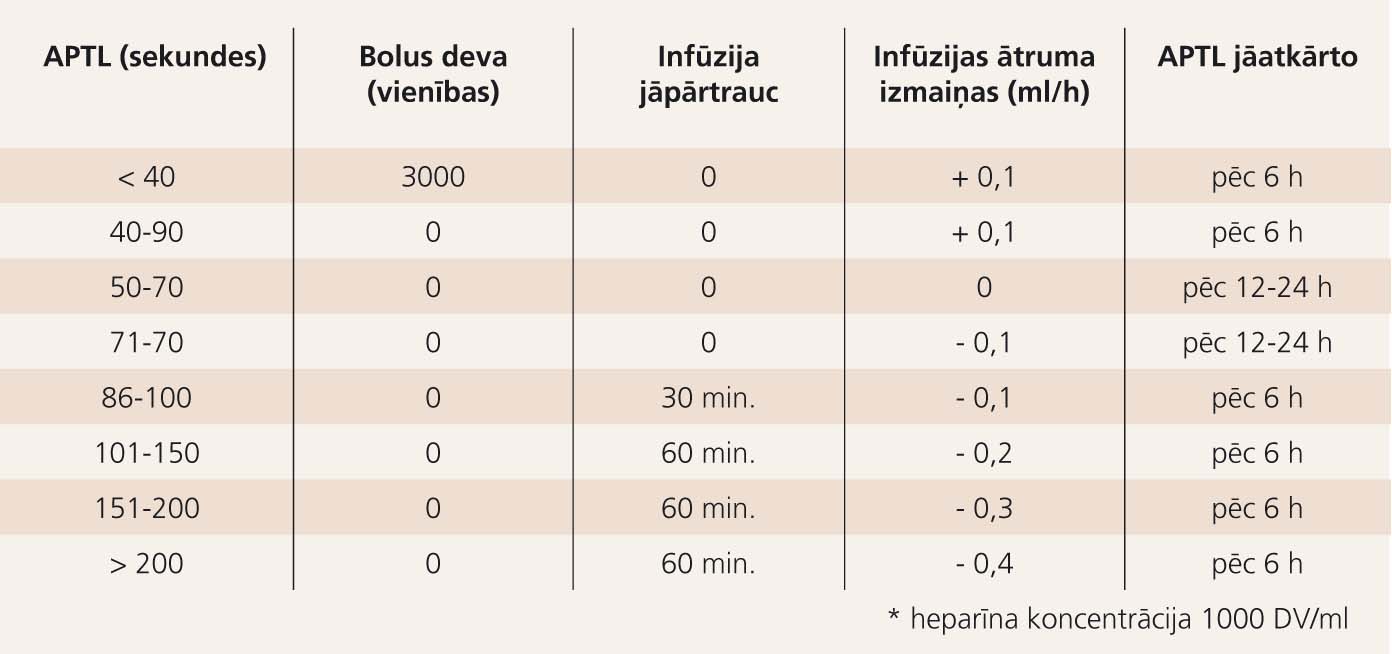

2. tabula
Nomogramma nefrakcionētā heparīna infūzijas ātruma noteikšanai*
Pacientiem ar paaugstinātu troponīnu līmeni akūta koronāra sindroma gadījumā ir daudz augstāks nāves risks tuvāko nedēļu laikā nekā pacientiem ar normālu miokarda bojājuma bioķīmisko marķieru līmeni. Eiropas Kardiologu biedrība un Amerikas Kardioloģijas koledža/Amerikas Sirds asociācija ir apstiprinājusi troponīnu līmeņa noteikšanu kā standartu miokarda infarkta diagnostikā un tālākās ārstēšanas taktikas izvēlē, sevišķi pacientiem ar akūtu koronāru sindromu bez ST segmenta elevācijas. [3] Taču jāņem vērā, ka troponīnu līmenis var būt paaugstināts arī citu slimību gadījumos:
- smaga sirds mazspēja (akūta un hroniska),
- aortāla sirdskaite,
- aortas disekcija,
- hipertrofiska kardiomiopātija,
- sirds kontūzija,
- pēc radiofrekvenču kateterablācijas, elektrokardioversijas, miokarda biopsijas, sirds ķirurģijas,
- miokardīts, endokardīts, perikardīts,
- hipertensīva krīze,
- tahiaritmijas, bradiaritmijas, blokādes,
- Takotsubo kardiomiopātija (apical balloning syndrome),
- plaušu artērijas trombembolija,
- smaga pulmonāla hipertensija,
- hipotireoze,
- hroniska vai akūta nieru mazspēja,
- akūtas neiroloģiskas slimības, ieskaitot insultu un subarahnoidālu asinsizplūdumu,
- infiltratīvas slimības: amiloidoze, hemohromatoze, sarkoidoze, sklerodermija,
- medikamentu ietekme: adriamicīns, 5-fluoruracils, herceptīns,
- apdegumi (ja skarti > 30% no ķermeņa virsmas laukuma),
- rabdomiolīze,
- kritiski slimi pacienti, īpaši pacienti ar elpošanas mazspēju vai sepsi,
- ekstrēma slodze (piemēram, maratons). [3]
Sepses gadījumā troponīnu līmenis ir paaugstināts līdz 85% pacientu. Literatūras dati liecina, ka paaugstināts troponīnu līmenis norāda uz augstu mirstības risku pacientiem ar nieru mazspēju, smagu sirds mazspēju, sepsi, insultu, plaušu artērijas trombemboliju, pat ja tiem nav zināma koronāra sirds slimība. [3; 6]
Ja troponīnu noteikšana nav pieejama, vislabākā alternatīva ir kreatīnkināzes MB masas noteikšana.
![Hroniskas nieru slimības pakāpes [4]](https://cdn.doctus.lv/media/2011/09/2/original/4b4ba0787bf4.jpg)
![Hroniskas nieru slimības pakāpes [4]](https://cdn.doctus.lv/media/2011/09/2/original/4b4ba0787bf4.jpg)
3. tabula
Hroniskas nieru slimības pakāpes [4]
Citi marķieri
- Nedaudz straujāk nekā troponīnsT asinīs paaugstinās kreatīnkināzes MB masa. Tās līmenis parasti normalizējas četru dienu laikā, tādēļ to izmanto miokarda infarkta recidīvu diagnostikā, kā arī miokarda infarkta gaitas un ārstēšanas efektivitātes izvērtēšanā.
- Būtiska loma miokarda infarkta recidīva diagnostikā ir mioglobīnam - zemas molekulmasas proteīnam, kas atrodams gan miokarda, gan skeleta muskuļu šūnās. Tas nav miokarda bojājumam specifisks marķieris, taču tā līmenis asinīs palielinās jau divas stundas pēc miokarda infarkta sākuma un samazinās jau pirmajās 24 stundās, tādēļ atkārtotās analīzēs tā klīniskā lietderība ir ierobežota.
- Kopējās kreatīnkināzes līmeņa noteikšanai ir salīdzinoši neliela nozīme miokarda infarkta diagnostikā zemā specifiskuma dēļ. LDH un ASAT šobrīd vispār netiek izmantoti miokarda bojājuma diagnostikā.
- Ja EKG un miokarda bojājuma marķieru analīzes dinamikā ir bez novirzēm, diagnozes precizēšanai un turpmākās terapijas taktikas izvērtēšanai rekomendē papildizmeklējumus (slodzes testu, ehokardiogrāfiju, miokarda perfūzijas scintigrāfiju). Nepieciešamības gadījumā tiek veikta koronāro artēriju angiogrāfija. [1]
Pilna asins aina un koagulogramma
Regulāra pilnas asins ainas kontrole ļauj savlaicīgi konstatēt gan iespējamu asiņošanu (Hb samazināšanos), gan paaugstinātu asiņošanas risku (trombocitopēniju), pat ja sākotnējie rādītāji ir normas robežās. Pacientiem ar miokarda bojājumu nereti ir nedaudz palielināts leikocītu skaits, taču, ja to skaits pieaudzis ievērojami, kā arī klīniski ir citi norādījumi par iekaisuma procesu, jāizslēdz pneimonija, Dreslera sindroms vai sepse (īpaši pacientiem, kam bijušas invazīvas procedūras).
Anēmija liecina par sliktu prognozi un paaugstinātu mirstību ne tikai pacientiem ar sirds mazspēju, nieru mazspēju, onkoloģiskām slimībām, bet arī akūta koronāra sindroma pacientiem. Saskaņā ar Pasaules Veselības organizācijas datiem 5-10% pacientu ar AKS bez ST segmenta elevācijas novēro anēmiju (hematokrīts
Sevišķi svarīgi monitorēt eritrocītu un hemoglobīna līmeni pacientiem, kas saņem plašu antitrombotisku preparātu spektru, kam veikta trombolītiska terapija, kā arī pacientiem pēc invazīvām procedūrām, jo hemoglobīna līmeņa samazināšanās (sevišķi, ja ir atbilstoša klīnika) var liecināt par nopietnu asiņošanu.
Asiņošanas profilakse
Asiņošana akūta koronāra sindroma pacientiem četras piecas reizes palielina atkārtota miokarda infarkta, insulta un nāves risku, tādēļ asiņošanas profilakse uzskatāma par vienu no svarīgākajiem AKS terapijas komponentiem. [4; 7]
Asiņošanas risku palielina lielas antitrombotisko medikamentu devas, dažādu antitrombotisku medikamentu kombinēšana, ārstēšanas ilgums. Asiņošanas risku ietekmē arī samazināta nieru funkcija, samazināts ķermeņa svars, pazemināts sākotnējais hemoglobīna līmenis un invazīvas procedūras. Asiņošana kā komplikācija biežāk sastopama sievietēm.
Nelielas asiņošanas gadījumā antikoagulantu un antitrombotisko medikamentu pārtraukšana AKS ārstēšanas vadlīnijās netiek rekomendēta. Nopietnas asiņošanas gadījumā antikoagulantu un antitrombotisko preparātu lietošana jāpārtrauc, ja vien nav panākta pilnīga hemostāze. Asins formelementu transfūzija apsverama individuāli, jo, kā liecina līdzšinējie pētījumi, tai var būt negatīva ietekme uz klīnisko iznākumu. Šobrīd tiek uzskatīts, ka hemodinamiski stabiliem pacientiem ar hematokrītu > 25% un hemoglobīna līmeni > 8 g/dl asins formelementu transfūzija nav nepieciešama. Vienlaikus jāatceras, ka anēmija ir nozīmīgs atkārtotu išēmisku notikumu riska faktors. [4]
![Dažu medikamentu dozēšana pacientiem ar hronisku nieru slimību [4]](https://cdn.doctus.lv/media/2011/09/2/original/4c830c4cddd8.jpg)
![Dažu medikamentu dozēšana pacientiem ar hronisku nieru slimību [4]](https://cdn.doctus.lv/media/2011/09/2/original/4c830c4cddd8.jpg)
4. tabula
Dažu medikamentu dozēšana pacientiem ar hronisku nieru slimību [4]
Rekomendācijas anēmijas gadījumā (Eiropas Kardiologu biedrības
vadlīnijas) [4]
- Zems sākotnējais hemoglobīna līmenis ir neatkarīgs išēmisku notikumu un asiņošanas marķieris 30 dienu laikā pēc akūta koronāra sindroma. Tas jāņem vērā, novērtējot sākotnējo pacienta risku.
- Jau sākotnējās terapijas laikā ir jāveic nepieciešamās analīzes, lai izvairītos no anēmijas progresa asiņošanas dēļ.
- Ja AKS pacientam jau sākotnēji ir anēmija, ko viņš labi tolerē, asins formelementu transfūzija apsverama tikai kompromitētas hemodinamikas gadījumā.
Rekomendācijas trombocitopēnijas gadījumā (Eiropas Kardiologu biedrības vadlīnijas) [4]
Trombocitopēnija akūta koronāra sindroma gadījumā bieži saistīta ar heparīna vai GP IIb/IIIa inhibitoru lietošanu.
- Nozīmīgatrombocitopēnija (
- Izteiktas GP IIb/IIIa inhibitoru terapijas izraisītas trombocitopēnijas (
- Heparīna (nefrakcionēta vai ZMMH) terapijas pārtraukšana ir pamatota, ja pacientam ir zināma heparīna inducēta trombocitopēnija (HIT) vai arī ir aizdomas par to. Trombotisku komplikāciju gadījumā antikoagulāciju jānodrošina ar tiešiem trombīna inhibitoriem.
- HIT profilaksei kā antikoagulantus var izmantot fondaparinuksu vai bivalirudīnu, vai arī heparīnu nozīmēt īslaicīgi.
APTL kontrole heparīna terapijas laikā
Pacientiem, kas saņem nefrakcionētu heparīnu (piemēram, pēc trombolītiskas terapijas ar fibrīnspecifiskiem preparātiem - alteplāzi, reteplāzi, tenektoplāzi) vai tiešos trombīna inhibitorus, nepieciešama regulāra APTL (aktivētais parciālais tromboplastīna laiks) kontrole. Mērķa APTL ir 50-70 sekundes. Pēc heparīna terapijas uzsākšanas APTL kontrole veicama ne ātrāk kā pēc četrām stundām. Nefrakcionētā heparīna infūzijas ātrums tiek noteikts pēc nomogrammas atkarībā no APTL (2. tabula). Ja APTL ir terapetiskās robežās, tā līmenis tāpat atkārtoti jānosaka vismaz vienreiz diennaktī.
Heparīna terapijas gadījumā noteikti jāseko arī trombocītu skaitam, lai savlaicīgi diagnosticētu heparīna inducētu trombocitopēniju, kuras gadījumā nekavējoties jāpārtrauc nefrakcionētā heparīna ievadīšana.
Galvenais nefrakcionētā heparīna trūkums - mainīga devas atkarīga efekta līkne, ko nosaka nefrakcionētā heparīna saistīšanās ar citiem plazmas olbaltumiem, ne tikai antitrombīnu. Heparīna antitrombotisko aktivitāti samazina arī ar recekli klāta trombīna spēja pretoties heparīna inhibīcijai un heparīna jutība pret trombocītu 4. faktoru.
Pretstatā nefrakcionētam heparīnam zemas molekulmasas heparīnus raksturo prognozējama farmakokinētika, augsta biopieejamība, garāks plazmas pusizvades periods. To lietošanas laikā nav nepieciešamības kontrolēt APTL. ZMMH ir preparāti ar īsākām polisaharīdu ķēdēm un ar dažādu antiXa:antiIIa faktoru aktivitātes attiecību. Tie mazāk stimulē trombocītus un retāk izsauc trombocitopēniju. Kā liecina Extract/TIMI 25 pētījuma dati, ZMMH lietojami arī pacientiem pēc trombolītiskas terapijas ar fibrīspecifiskiem preparātiem.
Atsevišķos gadījumos ir vērojama heparīna rezistence (APTL līmenis nepieaug, neraugoties uz augstām heparīna devām). Šajā gadījuma var izvēlēties citas grupas antikoagulantus - trombīna tiešos inhibitorus, pie kuriem pieder, piemēram, bivalirudīns. Bivalirudīns palielina vairākus koagulācijas rādītājus - APTL, ACT (activated clotting time), trombīna un protrombīna laiku, taču, tā kā tam ir ļoti īss darbības laiks, koagulācijas rādītāji parasti normalizējas jau vienas divu stundu laikā pēc bivalirudīna ievades pārtraukšanas, līdz ar to šī antikoagulanta darbība ir labi kontrolējama.
Nieru funkcija
No nieru funkcijas akūta koronāra sindroma pacientiem atkarīga gan ārstēšanas taktikas, gan arī medikamentu izvēle un to deva.
Svarīgākie nieru funkcionālie rādītāji ir kreatinīna un kālija līmenis, glomerulu filt rācijas ātrums (GFĀ) un kreatinīna klīrenss. Glomerulu filtrācijas ātrumam, salīdzinot ar seruma kreatinīnu, ir augstāka jutība. Tā līmenis korelē ar glomerulārā un tubulointersticiālā bojājuma smaguma pakāpi. Zināms, ka aptuveni 24% pacientu ar koronāro sirds slimību GFĀ ir zem 60 ml/ min./1,73 m² (3. tabula).
Kontrastvielas inducēta nefropātija (KIN) attīstās aptuveni 15% pacientu, kas saņēmuši jodu saturošas kontrastvielas. [8] Par kontrastvielas inducētu akūtu nieru bojājumu uzskata nieru funkcijas pasliktināšanos trīs dienas pēc kontrastvielas ievades, ja nav citu etioloģisko faktoru. KIN tiek definēta kā seruma kreatinīna palielināšanās par ≥ 25% no sākotnējā līmeņa vai par ≥ 0,5 mg/dl (44 μmol/l). 80% gadījumu kreat inīna līmenis paaugstinās 24 stundu laikā, maksimumu sasniedzot trīs, četras dienas pēc kontrastvielas ievades. [8; 9] Samazināta nieru funkcija koronāras sirds slimības pacientiem pēc PCI palielina komplikāciju un hospitālās mirstības risku. KIN risks palielinās un ir klīniski nozīmīgāks pacientiem ar hronisku nieru slimību, īpaši, ja tā kombinējas ar cukura diabētu un ja GFĀ Iodixanol) vai zemas osmolaritātes kontrastvielām.
Rekomendācijas pacientiem ar hronisku nieru slimību (Eiropas Kardiologu biedrības vadlīnijas) [4]
- Kreatinīna klīrenss un/vai GFĀ jānosaka katram pacientam, kas hospitalizēts ar akūtu koronāru sindromu bez ST segmenta elevācijām. Sevišķa uzmanība jāpievērš gados vecākiem pacientiem, sievietēm un pacientiem ar pazeminātu ķermeņa svaru, jo šai pacientu grupai arī pazemināta kreatinīna klīrensa un GFĀ gadījumā var būt normāls seruma kreatinīna līmenis.
- Pacientiem ar hronisku nieru slimību jāsaņem tāda pati pirmās rindas terapija kā citiem AKS pacientiem, izņemot gadījumus, kad tā ir kontrindicēta.
- Pacientiem, kam kreatinīna klīrenss
- Nefrakcionētā heparīna infūzijas ātrums atkarīgs no APTL, ja kreatinīna klīrenss
- GP IIb/IIIa inhibitorus var lietot nieru mazspējas gadījumā. Eptifibatīdam un tirofibānam nepieciešama devas korekcija. Sevišķi liela vērība jāpievērš iespējamam asiņošanas riskam, izmantojot abciksimabu.
- Pacientiem ar hronisku nieru slimību un kreatinīna klīrensu
- Atbilstoši aprēķini tiek ieteikti, lai samazinātu kontrastvielas izraisītas nefropātijas attīstību.
Kontrastvielas inducētas nefropātijas profilakse un riska faktori [10]
Adekvāta intravenoza hidratācija 1 ml/ kg/h fizioloģiskā šķīduma 24 stundu laikā (uzsākot 12 stundas pirms kontrastvielas ievades), salīdzinot ar neierobežotu perorālu hidratāciju, ievērojami samazina kontrastvielas inducētas nefropātijas attīstību (3,7% pret 34,6%). KIN attīstības risku palielina arī nefrotoksiski medikamenti (nesteroīdie pretiekaisuma līdzekļi, aminoglikozīdi, ciklosporīni u. c.), tādēļ to lietošanu iesaka pārtraukt 24 stundas pirms paredzamās kontrastvielas ievades, ja vien tas iespējams. Minimāla zemas osmolaritātes vai izoosmolāras kontrastvielas tilpuma lietošanai ir ievērojami zemāka KIN attīstība, salīdzinot ar augstas osmolaritātes kontrastvielām. Ikdienas nieru rādītāju monitorings pēc kontrastvielas ievadīšanas ļauj agrīni diagnosticēt nieru mazspēju un uzsākt savlaicīgu ārstēšanu. Kontrastvielas inducētas nefropātijas riska mazināšanas stratēģija ietver pietiekama šķidruma daudzuma nodrošināšanu, piemērotas kontrastvielas izvēli un kontrastvielas tilpuma samazināšanu. Maksimālais kontrastvielas daudzums (KIN riska mazināšanai) = sākotnējais kreatinīna klīrenss x 3,7.
Kontrastvielas inducētas nefropātijas riska faktori:
- nieru mazspēja anamnēzē,
- cukura diabēts,
- vecums > 75 gadi,
- vienlaicīga nefrotoksisku medikamentu lietošana (nesteroīdie pretiekaisuma līdzekļi, aminoglikozīdi u. c.),
- dehidratācija,
- hipotensija,
- anēmija,
- hiponatriēmija,
- sirds mazspēja,
- aknu ciroze,
- nefrotisks sindroms,
- arteriāla hipertensija,
- liels kontrastvielas daudzums (>200 ml). [10]
Nieru rādītāji var pasliktināties arī akūta koronāra sindroma pacientiem ar akūtu sirds mazspēju, sevišķi nestabilas hemodinamikas gadījumos. Sastrēguma sirds mazspējas gadījumā pacientiem var ievērojami pieaugt arī aknu transamināžu līmenis. Pacientiem ar oligoūriju vai anūriju nieru un aknu rādītāju kontrole paralēli centrālā venozā spiediena monitorēšanai ir sevišķi svarīga, lai savlaicīgi novērtētu indikācijas nieru aizstājējterapijai. Savukārt elektrolītu disbalanss akūta koronāra sindroma pacientiem var izraisīt dažādus sirds ritma un vadīšanas traucējumus. Pacientiem ar paaugstinātu glikozes līmeni jānodrošina regulāra glikēmijas kontrole.
4. tabulā atspoguļota atsevišķu medikamentu dozēšana atkarībā no nieru rādītājiem pacientiem ar hronisku nieru mazspēju.