Doctus februāra numurā ieskatījāmies nelielā HOPS komplikāciju daļā, lielāko uzsvaru liekot uz HOPS paasinājuma atpazīšanu un ārstēšanu. Šajā numurā plašāks ieskats pulmonālās hipertensijas (PH) un hroniskas elpošanas mazspējas radītajos izaicinājumos. Raksta noslēgumā torakālā ķirurga skaidrojums par ķirurģisku komplikāciju radīto slogu HOPS pacientiem, kā arī ģimenes ārsta skatījums uz ikdienas sadarbību un līdzestību.
Pulmonālā hipertensija
PH ir bieža un nozīmīga HOPS komplikācija. Tā saistīta ar sliktāku klīnisko gaitu, biežāku paasinājumu risku, īsāku dzīvildzi un lielāku resursu patēriņu. [1]
PH definīcijas pamatā ir hemodinamikas izvērtēšana, veicot sirds labās puses katetrizāciju. Lai gan hemodinamika ir galvenais PH raksturošanas elements, galīgajai diagnozei un klasifikācijai jāatspoguļo viss klīniskais konteksts un jāņem vērā visi veiktie izmeklējumi. [2] Plaušu hipertensiju definē ar mPAP (plaušu vidējo arteriālo spiedienu) > 20 mmHg miera stāvoklī. РН uzskata par smagu, ja mPAP ≥ 35 mmHg vai mPAP > 20 mmHg ar paaugstinātu spiedienu labajā priekškambarī (> 14 mmHg) un/vai sirds indekss < 2 l/min./m2. [3]
Plaušu sirds (cor pulmonale) ir PΗ komplikācija — PH izraisītas strukturālas labā kambara izmaiņas (piemēram, hipertrofija vai dilatācija) un/vai funkcijas traucējumi, kas saistīti ar hronisku plaušu slimību un/vai hipoksēmiju. [4]
PH klīniski var izpausties kā izolēta slimība (idiopātiska pulmonāla arteriālā hipertensija), kuras etioloģija ir nezināma, vai arī kā komplikācija, kas saistīta ar citām patoloģijām. Pašreizējā PH klasifikācija iedala to piecās plašās kategorijās, kas ietver procesus ar kopīgiem patogēniem mehānismiem. [1]
- 1. grupa — pacienti ar plaušu arteriālo hipertensiju (idiopātiska PΑH, ģenētiski pārmantota PAH, ar iedzimtām sirds slimībām asociēta, medikamentu un toksīnu izraisīta, ar HIV asociēta, ar sirds slimībām asociēta, portopulomonāla),
- 2. grupa — kreisās puses sirds slimību dēļ,
- 3. grupa — hronisku plaušu slimību un hipoksijas dēļ,
- 4. grupa — hroniska trombemboliska PH,
- 5. grupa — neidentificētu vai jauktu mehānismu dēļ.
PH, kas saistīta ar plaušu slimībām un/vai hipoksiju (3. grupa klasifikācijā), ierindojama starp visbiežāk sastopamajām PH formām, kuru visbiežākais cēlonis ir HOPS. [1]
Vairāki pētījumi ziņo, ka PH pacientiem ar HOPS parasti ir viegla, tās sastopamība 25—90 %. Tomēr šie dati nav objektīvi, jo iegūti no pacientiem ar smagu HOPS, kuri izvērtēti plaušu transplantācijai. Tika analizēti sirds labās puses katetrizācijas dati, kas ir precīzāki nekā ehokardiogrāfijas dati.
Mazāka sastopamība, visticamāk, ir pacientiem ar vieglu—mērenu HOPS, taču sirds labās puses katetrizācijas dati šajā populācijā ir mazāk pieejami un lielākā daļa novērtējumu tiek iegūti, analizējot ehokardiogrāfijas datus.
PΗ miera stāvoklī cilvēkiem ar mērenu HOPS svārstās no 20 % līdz 60 %. Laika gaitā PH var attīstīties, un vienā pētījumā ziņots, ka 25 % pacientu ar mērenu HOPS un normālu mPAP miera stāvoklī septiņos gados attīstījās PΗ (definēta kā mPAP > 20 mmHg uz RНС).
PH smagums, iespējams, korelē ar hipoksēmijas, hiperkapnijas un plaušu ventilācijas funkciju. Pacientiem ar FEV1 < 1 l labā kambara hipertrofija konstatēta 40 % gadījumu un pacientiem ar FEV1 < 0,6 l — 70 % gadījumu. [5]
Patoģenēze
PH patoģenētiskais cēlonis ir hipoksiska plaušu vazokonstrikcija ar sekojošu plaušu asinsvadu gultnes remodelāciju. Lielākā daļa datu iegūti no pacientiem ar HOPS, taču šie mehānismi, visticamāk, ir kopīgi visām 3. grupas PH patoloģijām.
Hipoksiska plaušu asinsvadu vazokonstrikcija — normāls regulācijas mehānisms, kura mērķis ir ierobežot asins plūsmu uz hipoksiskām alveolām un saglabāt ventilācijas un perfūzijas atbilstību (V/Q match). Gan alveolārā hipoksija, gan perifēro artēriju hipoksēmija var veicināt hronisku plaušu asinsvadu vazokonstrikciju. Tās ietekme uz plaušu asinsvadu spiedienu ir atkarīga no hipoksijas ilguma.
Asinsvadu remodelācija — laika gaitā novērojamas patoloģiskas asinsvadu izmaiņas. Sākotnēji tās ietver arteriolu distālo neomuskularizāciju, asinsvadu iekšējā slāņa sabiezējumu un mediālo hipertrofiju. Vēlāk asinsvadu ārējā slānī nogulsnējas patoloģiska kolagēna matrice, rezultātā šīs izmaiņas izraisa perifēro asinsvadu skaita samazināšanos un palielinātu perifēro asinsvadu pretestību, kāda novērota PΗ gadījumā. [3]
Diagnostika
PH diagnostika pacientiem ar plaušu slimībām ir komplicēta, jo daudzi no pašas plaušu slimības simptomiem imitē ΡH simptomus (piemēram, elpas trūkums, nogurums, vājums).
Klīniskās pazīmes, kas var liecināt par PH, ir vairākas. [3]
- Aizdusa vai hipoksēmija, kas nav pilnībā izskaidrojama ar plaušu parenhīmas slimības pakāpi vai pamatslimības smaguma pakāpi.
- Ātra oksigenācijas samazināšanās fiziskas slodzes laikā.
- Jebkuras klīniskās pazīmes, kas liecina par labās puses sirds mazspēju: sāpes krūtīs (piemēram, netipiskas sāpes krūtīs), sinkope vai presinkope, perifēras tūskas un/vai EKG, kas liecina par labās ass novirzi, labā priekškambara palielināšanos un/vai labā kambara hipertrofiju.
- Plaušu datortomogrāfijā par PH liecina palielinātas plaušu artērijas, perifēro plaušu asinsvadu pavājināšanās vai labā kambara palielināšanās.
- Smags gāzu difūzijas kapacitātes samazinājums (piemēram, < 30 % no prognozētā), it īpaši, ja tas nav proporcionāls plaušu ventilācijas funkcijas traucējumu smagumam.
Ja radušās lielas klīniskas aizdomas par PH, veic transtorakālo ehokardiogrāfiju, lai identificētu pazīmes, kas raksturīgas paaugstinātam plaušu artēriju spiedienam. Transtorakālā ehokardiogrāfija ļauj neinvazīvi izmērīt plaušu artēriju vidējo spiedienu jeb mPAP, izmantojot tā netiešos marķierus — plaušu artēriju sistolisko spiedienu vai labā kambara sistoliskā spiediena lielumus. [6]
Dažiem pacientiem klīnisko 3. grupas PH diagnozi var noteikt pēc klīniskā novērtējuma un atradēm ehokardiogrāfijā, kas liecina par PH. Citkārt PH var galīgi apstiprināt ar sirds labās puses katetrizāciju (RHC), ja mPAP > 20 mmHg.
Papildu testi
Ja radušās aizdomas par ΡΗ, iespējams veikt dažādus papildu diagnostiskos testus: nakts oksimetriju, polisomnogrāfiju, ventilācijas/perfūzijas (V/Q) skenēšanu un/vai plaušu arteriogrāfiju DT (lai noteiktu trombembolisko slimību vai plaušu artēriju obstrukciju; 4. grupas PH), sešu minūšu iešanas testu, kardiopulmonālās slodzes testu (var palīdzēt 3. grupas PH atšķirt no 2. grupas PH) un laboratoriskos izmeklējumus (piemēram, arteriālās asins gāzes, NT–proBNP, HIV, aknu rādītāji un saistaudu slimību skrīnings).
Ārstēšana
Pacientiem ar plaušu slimībām un/vai hipoksēmiju, kuriem ir viegla—mēreni smaga PH, parasti nepieciešami tikai vispārīgi atbalsta pasākumi. Visām vieglas PH pacientu grupām jāveic rūpīga izmeklēšana ik pēc 6—12 mēnešiem, lai novērotu progresējošās PH pazīmes un simptomus.
Slimībai progresējot un attīstoties hipoksēmijai un/vai sirds mazspējas simptomātikai, tiek nozīmēta terapija ar skābekli un diurētiķiem. Medikamenti, ko izmanto citu PH grupu terapijā (selektīvie prostaciklīnu receptoru agonisti [], fosfodiesterāzes–5 (PDE5) inhibitori (piemēram, sildenafils, tadalafils), slāpekļa oksīda—cikliskā guanozīna monofosfāta uzlabotāji, šķīstošā guanilāta ciklāzes stimulējošie līdzekļi (riociguats) un endotelīna receptoru antagonisti (piemēram, bosentāns, ambrisentāns, macitentāns), nav pierādījuši efektivitāti pacientiem ar 3. grupas PH.
Vājie rezultāti PAH mērķtiecīgā terapijā šajā populācijā daļēji izskaidrojami ar šo līdzekļu vazodilatējošajām sekām, kas var pasliktināt ventilācijas—perfūzijas traucējumus un gāzu apmaiņu pacientiem ar plaušu slimībām. [7] Pacientiem ar HOPS un progresējošu PH tiek apsvērta plaušu transplantācija.
Hroniska elpošanas mazspēja
Elpošanas mazspēja ir nespēja oksigenēt (piegādāt skābekli) vai ventilēt (izelpot CO2). Iedala:
- 1. tipa — hipoksēmiska elpošanas mazspēja: pO2 < 60 mmHg (pCO2 N vai < 33 mmHg).
- 2. tipa — hiperkapniska elpošanas mazspēja: pCO2 > 50 mmHg un pO2< 60 mmHg.
Patoģenēzes pamatā ir kaitīgo vielu (piemēram, cigarešu dūmu) ieelpošanas radīts hronisks iekaisums un oksidatīvais stress, kas palielina neitrofilo leikocītu, makrofāgu un limfocītu aktivitāti. Tāpēc palielinās citokīnu izdale, tiek stimulēta augšanas faktora izdale. Tas veicina peribronhiolārās fibrozes attīstību, kas sašaurina elpceļus un ilgtermiņā izraisa elpceļu obstrukciju. [8; 9] Iekaisuma process veicina gļotu hipersekrēciju un nelabvēlīgi ietekmē mukociliāro funkciju.
Sīko elpceļu un plaušu asinsvadu rajonā attīstās gludās muskulatūras hiperplāzija, galvenokārt kā atbildreakcija uz hipoksisku vazokonstrikciju, → attīstās plaušu hipertensija, kas var komplicēties ar sirds labās puses mazspēju. [10; 11]
Bronhopulmonāls iekaisums veicina proteāžu (īpaši elastāzes) izdalīšanos. Nikotīna lietošana vai citu kaitīgu vielu klātiene inaktivē proteāžu inhibitorus, piemēram, α1 antitripsīnu, izraisot proteāžu un antiproteāžu nelīdzsvarotību. [12] Palielināta elastāzes aktivitāte iznīcina alveolu sienas → palielinās elpceļu tilpums, samazinās elastība un palielinās plaušu pakļāvība → notiek elpceļu sabrukšana un obstrukcija, radot gaisa iestrēgšanu un hiperinflāciju. Gaisa iestrēgšana izraisa samazinātu ventilāciju, kas palielina “mirušo” telpu un samazina gāzu apmaiņu. [8]
Plaušu šunts un samazināts asins tilpums plaušu kapilāros palielina ventilēto, bet nepietiekami perfuzēto alveolu skaitu, kas veicina hipoksēmiju un hipekapniju, kā arī vēl vairāk pasliktina DLCO un V/Q attiecību. [13]
Hroniskas elpošanas mazspējas klīniskie simptomi
Pacientiem ar hronisku elpošanas mazspēju var novērot šādus simptomus:
- elpas trūkums — pakāpeniski palielinās, un tas var būt izteikts pat miera stāvoklī,
- nogurums — pastāvīgs nogurums un samazināta fiziskā izturība,
- hiperkapnijas simptomātika: galvassāpes, galvas reiboņi,
- sirds ritma traucējumi — var rasties tahikardija un citi ritma traucējumi,
- cianoze: zila ādas krāsa, kas norāda uz zemu skābekļa līmeni asinīs.
Ārstēšana
- Skābeklis. Ilgstoša skābekļa terapija pastāvīgas hroniskas hipoksēmijas gadījumā, ja parciālais arteriālā skābekļa spiediens PaO2 ≤ 55 mmHg vai ja PaO2 ≤ 60 mmHg un ja ir respiratora vai kardiāla slimība ar sekundāru policitēmiju (hematokrīta līmenis ≥ 55 %) vai PH, vai perifērām tūskām, vai nakts hipoksēmiju (SpO2 < 90 % vairāk nekā 30 % no miega perioda). [14]
- Elpceļu pozitīvā spiediena terapija. Neinvazīvais ventilācijas atbalsts, kas indicēts pacientiem ar hronisku 2. tipa elpošanas mazspēju, ko izraisa HOPS un kas izpaužas ar dienas hiperkapniju vai nakts hipoksēmiju. Indikācijas šādai terapijai ir dienas hiperkapnija PaCO2 ≥ 52 mmHg. Diagnozes precizēšanai jāveic miega poligrāfija ar nakts transkutāno kapnogrāfiju. Terapijas sākšana miega laboratorijā vai stacionārā nodrošina atbilstošas maskas pielāgošanu, spiediena iestatījumus un pacienta pieņemšanu ierīces lietošanā. [15]
Ģimenes ārsta loma HOPS pacienta aprūpē ir ļoti nozīmīga
Dr. LUDMILA TERJAJEVA: “Kā lielākos izaicinājums ikdienas praksē ar HOPS pacientu varu minēt vairākus.
- Agrīna atklāšana un diagnostika: HOPS simptomi bieži parādās pakāpeniski, tāpēc pacienti palīdzību meklē novēloti, kad plaušu funkcija jau ievērojami pasliktinājusies. Pacienti bieži nenovērtē elpas trūkumu, uzskatot to par sliktas fiziskās formas vai novecošanas sekām. Trūkst regulāras plaušu funkcijas pārbaudes, īpaši smēķētājiem, kam spirometrija būtu nepieciešama kā skrīninga metode.
- Medikamentu lietošana un terapijas efektivitāte. Te būtiskākās problēmas ir inhalatoru nepareiza lietošana, polifarmācija un nepietiekama līdzestība — pacienti bieži pārtrauc lietot zāles, kad jūtas labāk, bet tas izraisa paasinājumus.
- Smēķēšanas atmešana — psiholoģiski un fiziski sarežģīts process. Daudzi pacienti nespēj atmest smēķēšanu, jo trūkst motivācijas un atbalsta, īpaši, ja pēc smēķēšanas atmešanas nav tūlītēju uzlabojumu.
- Neefektīva profilakse — daudzi pacienti neveic specifisko aktīvo imūnprofilaksi pret gripu, Covid–19 un pneimokoku, kas varētu mazināt smagu komplikāciju un hospitalizācijas riskus.
- Fiziskās aktivitātes un rehabilitācijas izaicinājumi. Samazināta fiziskās slodzes panesība — pacienti bieži izvairās no kustībām, jo baidās no elpas trūkuma. Plaušu rehabilitācijas programmu pieejamība ir nepietiekama.
- Sociālie un ekonomiskie faktori. Medikamenti, ilgtermiņa skābekļa terapija un hospitalizācijas rada finansiālu slogu. Dzīves kvalitātes pasliktināšanās — slimība ierobežo ikdienas aktivitātes, tāpēc pacients aizvien vairāk izolējas.
Pacientu izpratne par inhalatoru lietošanas principiem ikdienā un HOPS paasinājuma laikā bieži ir nepietiekama, un tas ir viens no galvenajiem ārstēšanas efektivitātes izaicinājumiem. Šo problēmu raksturo daži būtiski aspekti: nepareiza inhalatoru lietošanas tehnika (ietekmē zāļu piegādi mērķī un depozīciju plaušās), nepietiekama izpratne par inhalatoru veidiem, līdzestības un zāļu lietošanas regularitātes trūkums, nepietiekama inhalatoru kopšana un pārmērīga īslaicīgo bronhodilatatoru lietošana.
Lai uzlabotu pacientu izpratni un inhalatoru lietošanas efektivitāti, svarīgi to ierādīt praktiski. Regulāri jāparāda, kā pareizi lietot inhalatorus, nevis jāskaidro tikai mutiski, un jāizmanto gan placebo inhalatori, gan izglītojoši materiāli un video.
Lai uzlabotu HOPS pacientu aprūpi un samazinātu komplikācijas, nepieciešama sistēmiska un multidisciplināra pieeja, kas ietver agrīnu diagnostiku, smēķēšanas atmešanu, inhalatoru pareizu lietošanu, fizisko aktivitāšu veicināšanu, vakcināciju un personalizētus rīcības plānus.
Kad pacientam ar HOPS strauji attīstās elpošanas mazspējas simptomi, vienmēr jāizslēdz spontāns pneimotorakss
HOPS un plaušu vēža kombinācija ir bieža!
Dr. ARTJOMS ŠPAKS: “Torakālā ķirurga ikdienas praksē bieži nonāk pacienti ar HOPS izpausmēm un sekām. Neapšaubāmi, ka HOPS var ietvert dažādus stāvokļus ar dažādu efektu uz cilvēka veselību.
Sekundārs pneimotorakss
Sekundārs pneimotorakss ir patoloģisks stāvoklis, kad gaiss uzkrājas pleiras dobumā kāda plaušu parenhīmas bojājuma slimības dēļ. Ņemot vērā HOPS biežumu, šī komplikācija klīniskajā praksē ir relatīvi bieža, un pneimotoraksa sastopamība pacientiem ar HOPS ir 26 gadījumi uz 100 000 HOPS pacientu. [16] Sekundārs pneimotorakss tiek uzskatīts par neatliekamu medicīnisku situāciju, kas tūlītēji jādiagnosticē un jāārstē. Vairāku faktoru dēļ sekundārs pneimotorakss ir bīstamāks par primāru.
- Pacientam ar plaušu slimību, piemēram, plaušu funkcionālā rezerve jau ir ierobežota, tāpēc pat neliels pneimotorakss var būt dzīvībai bīstams.
- Gaisa uzkrāšanās pleiras dobumā var saspiest plaušas un traucēt gāzu apmaiņu, ātri izraisot hipoksiju, kas ir saistīta ar virkni citu patoloģisku procesu.
- Smagos gadījumos var attīstīties spriedzes pneimotorakss, kad ar katru ieelpu gaiss turpina uzkrāties pleiras dobumā, izraisot plaušas saplakšanu, videnes nobīdi, lielo asinsvadu saspiešanu un potenciāli letāliem hemodinamikas traucējumiem.
- Sekundārs pneimotorakss bieži ir sarežģītāk ārstējams nekā primārs, jo bojātās plaušas sliktāk dzīst un sliktāk izplešas ārstēšanas procesā. Dažreiz nepieciešama ilgstoša pleiras drenāža vai pat ķirurģiska iejaukšanās. [17]
- Pacienti ar hroniskām plaušu slimībām ir pakļauti atkārtotu pneimotoraksu riskam, kas var ievērojami pasliktināt dzīves kvalitāti un prognozi.
Mirstība HOPS izraisīta pneimotoraksa gadījumā var sasniegt 5 % [18] un pieaugt kombinācijā ar citām HOPS komplikācijām.
Praksē situācijās, kad pacientam ar HOPS strauji attīstās elpošanas mazspējas simptomi, vienmēr jāizslēdz spontāns pneimotorakss, kura diagnostika ietver klīnisku izmeklēšanu ar auskultāciju un perkusiju, kā arī plaušu rentgenogrāfiju.
Pneimotoraksa ārstēšana
Ņemot vērā funkcionālās rezerves trūkumu, pneimotoraksa ārstēšana pacientiem ar HOPS prasa proaktīvu rīcību.
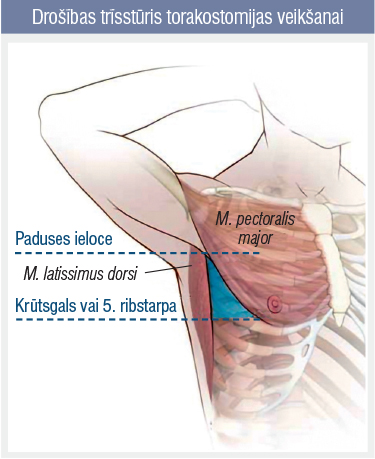

1.attēls
Gandrīz visos gadījumos ārstēšanas minimums ir torakostomija — pleiras dobuma drenāža caur adekvāta izmēra drenu (20—28F), kura ir ievadīta drošības trīsstūrī (1. attēls). Torakostomija negarantē labu iznākumu, jo HOPS pacientiem plaušu defekti dzīst un slēdzas daudz ilgāk, tāpēc var attīstīties parenhīmas—pleiras fistula. Šī situācija saistīta ar parādību, ko torakālajā ķirurģijā sauc par “gaisa nometienu” vai “gaisa noplūdi” — stāvokli, kad no plaušas defekta pastāvīgi izdalās gaiss, netiek panākts pleiras dobuma hermētisms un no pleiras drenāžas sistēmā ir redzami gaisa burbuļi. Situācijā, kad gaisa nometiens saglabājās ilgāk par septiņām dienām un torakostomija nevar atrisināt problēmu, tiek uzskatīts, ka pienācis brīdis iejaukties ķirurģiski, jo nogaidoša taktika palielina pleiras dobuma infekcijas — empiēmas risku, plaušu kontrakcijas atelektāzes risku, kā arī pasliktina dzīves kvalitāti. Atbilstīgi pacienta vispārējam stāvoklim piedāvājami dažādi ķirurģiskās iejaukšanas varianti:
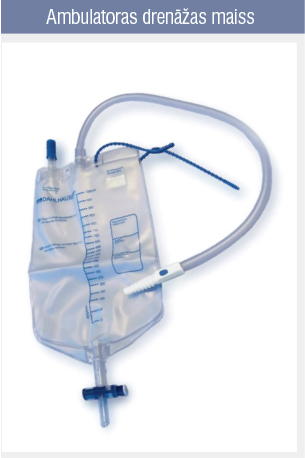

2.attēls
- pastāvīga torakostomija, kad pleiras drena tiek atstāta uz ilgāku laiku un pacients tiek izrakstīts ar drenu, kas pievienota ambulatoras drenāžas maisam (2. attēls), ierādot paņēmienus maisa lietošanai un kopšanai;
- talka pleirodēze caur drenu: sterila talka suspensijas ievade caur drenu, lai panāktu saaugumu procesu un pleiras dobuma obliterāciju. Saaugumu process palīdzēs slēgties plaušas defektam un samazinās pneimotoraksa recidīva risku. Procedūras veikšanai nav nepieciešama pilna narkoze, tikai lokāla atsāpināšana ar anestētiķa ievadi pleiras dobumā;
- torakoskopija ar plaušas defekta slēgšanu/bojātās plaušas daļas rezekciju kombinācijā ar pleirodēzi;
- torakoskopija ar pleiras tenta izveidi: operācijas laikā tiek atslāņota parietālā pleira — pleiras lapiņa, kas izklāj krūškurvja sienu. Plaušas parenhīmu apstrādā ar fibrīna līmi un virsū uzklāj parietālo pleiru, kas var veicināt parenhīmas dzīšanas procesu.
Plaušu vēzis
Ļoti bieži viens no galvenajiem HOPS attīstības faktoriem [19] ir smēķēšana, un pusei smēķētāju dzīves laikā parādīsies HOPS simptomi. Savukārt risks plaušu vēža attīstībai smēķētājiem ir 15—30 × lielāks [20] — tas nozīmē, ka HOPS un plaušu vēža kombinācija klīniskajā praksē ir bieža. Plaušu vēzis nav šā raksta tēma, bet vērts pieminēt, ka pacientiem ar plaušu vēzi HOPS var būtiski ietekmēt slimības gaitu un ierobežot ārstēšanas iespējas. Nav retas situācijas, kad tehniski ir iespējama plaušu rezekcijas operācija, tomēr to neveic ierobežotas plaušu funkcionālās rezerves dēļ. Pacientiem ar HOPS ir lielāks risks dažādiem perioperatīviem sarežģījumiem neatkarīgi no operācijas veida, [21] tāpēc pirms jebkura veida operācijas plānošanas ir jāizvērtē iespējas optimizēt pacienta stāvokli.
Novērojot pacientu ar HOPS un smēķēšanas anamnēzi, jāpatur prātā iespēja veikt oportūnistisku plaušu vēža skrīningu, proti, ārstam ir iespēja atlasīt līdzestīgus pacientus un nosūtīt viņus uz krūškurvja datortomogrāfiju reizi 1—2 gados.
Termināla elpošanas mazspēja
Ķirurģisku komplikāciju vai ķirurģiskas ārstēšanas kontekstā vērts pieminēt HOPS pacientus ar terminālu elpošanas nepietiekamību, kad vienīgā radikālā ārstēšanas metode ir plaušu transplantācija. Katru gadu pasaulē tiek veikts vairāk nekā 4600 plaušu transplantāciju, ~ 36 % no tām ir HOPS pacientiem. [22] Šobrīd Latvijā plaušu transplantāciju nepiedāvā, tomēr, pateicoties P. Stradiņa Plaušu slimību un torakālās ķirurģijas centra ārstu iniciatīvai, notiek darbs pie plaušu transplantācijas programmas attīstības.”