Saskaņā ar Globālās iniciatīvas astmas ārstēšanas (GINA) vadlīnijām
[1] 4–28% pieaugušo astmas pacientu aspirīns un citi nesteroīdie pretiekaisuma līdzekļi (NSPL) var izraisīt bronhiālās astmas uzliesmojumus. Šo klīnisko sindromu sauc par aspirīna inducēto astmu (AIA), un tās pamatā ir arahidonskābes metabolisma traucējumi, kas rada cistenilleikotriēnu pārprodukciju. Gandrīz pusei AIA norise ir smaga, tāpēc nepieciešama savlaicīga diagnostika un ārstēšana. Pacientiem būtu jāsniedz rakstiski ieteikumi par aizliegtajiem NSPL un atļautajiem alternatīvajiem medikamentiem.
Aktualitāte
Pirmās ziņas par aspirīna hipersensitivitāti publicēja Hiršbergs (Hirschberg) 1902. gadā. Ziņojumi par smagām, dažreiz pat fatālām bronhiālās astmas lēkmēm parādījās neilgi pēc tam, kad medicīniskajā praksē tika ieviesta aspirīna lietošana. Mūsdienās aspirīns un citi NSPL rada apmēram 25% no visām ziņotajām medikamentu blakusparādībām. To pamatā var būt gan imunoloģiskas, gan ne-imunoloģiskas hipersensitīvas reakcijas. Klīniski aspirīna un citu NSPL hipersensitivitāte izpaužas kā bronhiāla astma, rinosinusīts, anafilakse, nātrene un dažādas vēlīnas ādas un orgānu specifiskas reakcijas. Jaunākās EAACI rekomendācijas [2] iesaka, ņemot vērā reakcijas tipu, izmantot pakāpienveida pieeju NSPL hipersensitivitātes diagnostikā, ko pamato ar anamnēzi un in vitro un/vai provokācijas testiem ar vainīgo vai alternatīvo medikamentu.
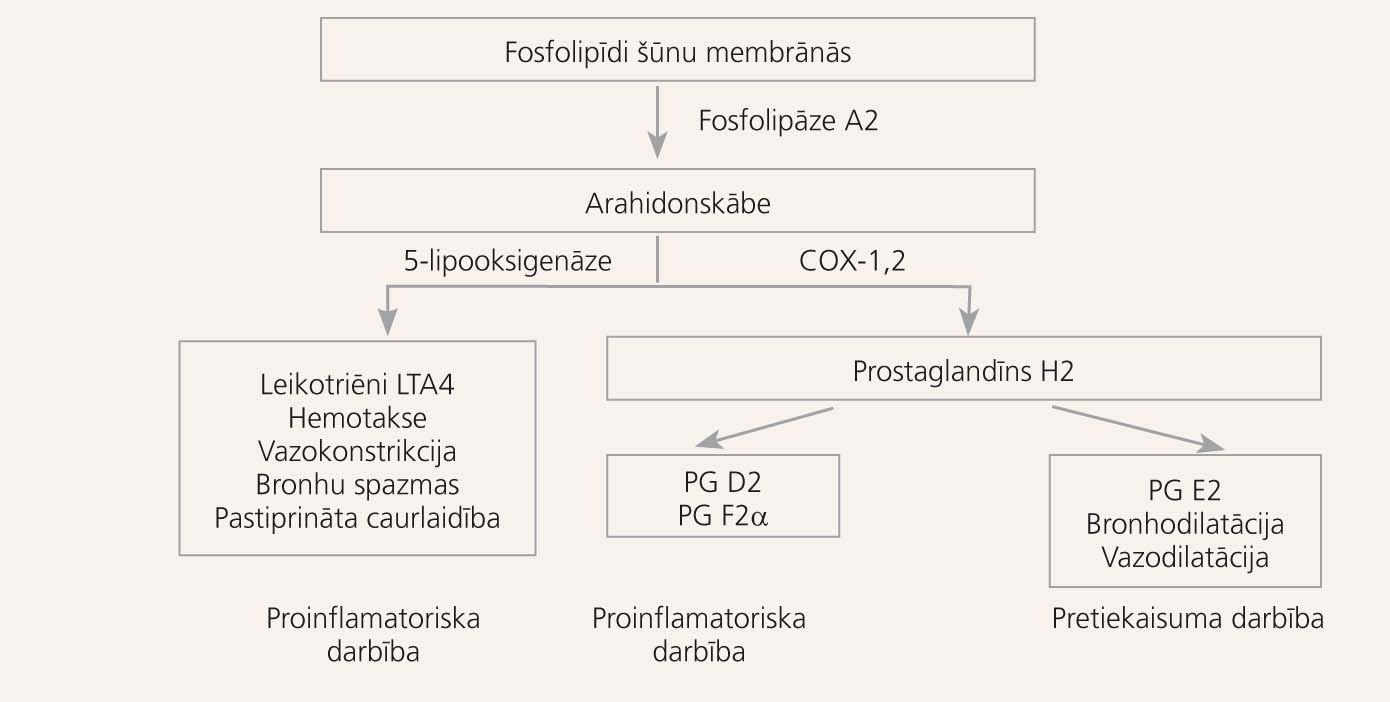
Saskaņā ar GINA vadlīnijām [1] 4-28% pieaugušo astmas pacientu aspirīns un citi nesteroīdie pretiekaisuma līdzekļi (NSPL) var izraisīt bronhiālās astmas uzliesmojumus. Veicot aspirīna provokācijas, AIA novēro 8-20% gadījumu, bet tikai pēc anamnēzes datiem ~ 5%. [5] Bērnu praksē novērots ļoti maz šādu gadījumu. [3] Klīniskās un zinātniskās intereses pieaugums par AIA atsākās 1990. gadu vidū, kad tika atklāta arahidonskābes metabolisma patoģenēze (skat. attēlu).

Attēls
Arahidonskābes metabolisms
Hipersensitivitātes mehānisms
Aspirīna astmas hipersensitivitātes mehānisms pieder ne-imunoloģisko hipersensitīvo reakciju tipam, un to nosaka medikamenta farmakoloģiskās īpašības. Aspirīns un citi NSPL ir ciklooksigenāzes inhibitori (COG), tādējādi kavējot arahidonskābes metabolizēšanos un prostaglandīnu, tromboksāna un prostaciklīnu rašanos. Saskaņā ar "ciklooksigenāzes" hipotēzi COG-1 (nevis COG-2) inhibēšana izsauc astmas lēkmes un/vai deguna simptomus. Prostaglandīna E2 (PGE2) mazināšanās, iespējams, veicina arahidonskābes metabolizēšanos, pateicoties lipooksigenāzei un iekaisuma aktivēšanai, jo pieaug lokālo un sistēmisko leikotriēnu produkcija. Tomēr mehānisms, kā aspirīns ietekmē ciklooksigenāzi, pilnībā nav izpētīts. Ne visi NSPL rada blaknes vienādi bieži, jo atšķiras to anticiklooksigenāzes spēja, devas, kā arī pacientu individuālais jutīgums.
Simptomi un izplatība
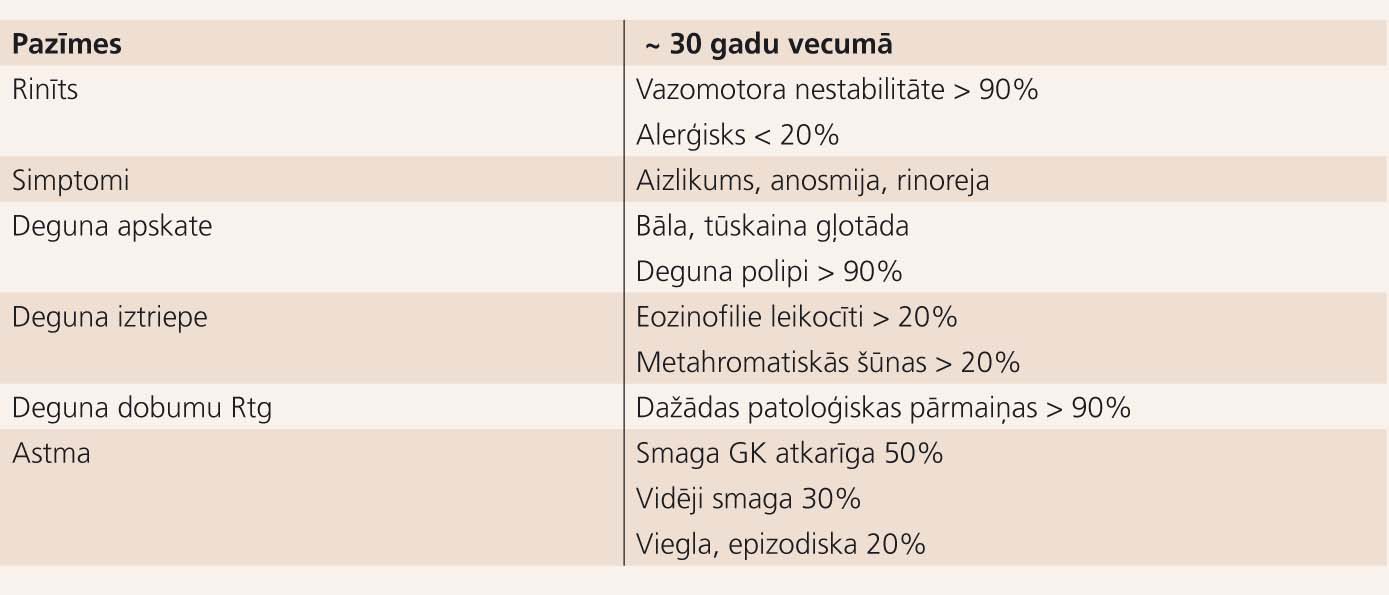
Lielākā daļa pacientu pirmos AIA simptomus jūt vecumā starp 30 un 40 gadiem, un sieviešu vidū tā sastopama biežāk. Parasti ir sūdzības par rinītu ar intensīvu rinoreju, tālāk parādās aizlikta deguna simptomi. Veicot deguna apskati, bieži konstatē polipus. Astma un aspirīna intolerance pievienojas vēlāk. Šo klasisko triādi sauc gan par Widala sindromu (aprakstīts 1922. gadā), aspirīna triādi, Samptera sindromu (aprakstīts 1960. gadu beigās), aspirīna inducēto astmu, aspirīna intoleranto astmu utt. Tās biežums populācijā ir 0,3-0,6%. Jaunākās EAACI rekomendācijas iesaka terminu "aspirīna saasināta plaušu slimība" (aspirin-exacerbated respiratory disease (AERD)), tādējādi uzsverot, ka aspirīna un citu NSPL lietošana tikai rada jau esoša hroniska elpceļu iekaisuma uzliesmojumu.
Klīniskā aina
AIA pacienta klīniskās pazīmes apkopotas 1. tabulā. [4] AIA klīniskā aina attīstās dažu minūšu līdz 2 stundu laikā pēc aspirīna lietošanas. Astmas simptomus pavada rinoreja un konjunktīvas nieze, sejas un kakla hiperēmija. Smagos gadījumos aspirīna vai kāda cita anticiklooksigenāzes (COG-1 inhibitora) grupas medikamenta lietošana var izraisīt spēcīgu bronhu spazmu, bezsamaņu, šoku un elpošanas apstāšanos. [5] Veicot bronhoskopijas ar gļotādas biopsiju, Nasser un kolēģi pierādīja persistējošu elpceļu iekaisumu ar ievērojamu eozinofīliju, epitēlija deskvamāciju, pastiprinātu citokīnu un adhēzijas molekulu produkciju. [6] Eozinofilo leikocītu skaits krēpās un bronhu skalojumā ir 15 reizes lielāks par normu un var 4 reizes pārsniegt aspirīna toleranto astmas pacientu rādītājus, jo pieaug interleikīna 5 (IL-5) ekspresija elpceļos. Tas veicina eozinofilo leikocītu rekrutēšanu, aktivāciju, nobriešanu un pagarina to dzīvildzi. [7] 70% AIA pacientu elpceļos atrod arī ģenētiski noteiktu leikotriēna C4 (LTC4) sintetāzes palielinātu ekspresiju, kas nosaka pastiprinātu cistenilleikotriēnu produkciju un bronhu konstrikciju.

1. tabula
Aspirīna inducētas astmas pazīmes
Pētījums
Lai labāk izpētītu AIA klīnisko norisi un slimības gaitu, 10 Eiropas valstīs tika organizēts pētījums. [8] 16 klīniskajos centros apsekoja 500 pacientu. Slimības klīniskā aina dažādās valstīs bija ļoti līdzīga. Pirmo reizi persistējoša rinīta diagnoze tika apstiprināta 29,7 ± 12,5 gados, vēlāk attīstījās astma, aspirīna intolerance un deguna polipoze. Sievietēm AIA attīstījās biežāk nekā vīriešiem (2,3 : 1), simptomi sākās agrāk un attīstījās smagāk. Atopija tika apstiprināta vienai trešdaļai pacientu. Tā izraisīja rinītu un astmu agrāk nekā neatopiskiem pacientiem, bet neietekmēja aspirīna intoleranci un deguna polipozi. Ģimenes anamnēzē AIA tika uzrādīta tikai 6% gadījumu. Tas ļauj secināt, ka iedzimtībai ir mazāka nozīme nekā dzimumam un atopijai. 51% pacientu paralēli inhalējamiem glikokortikoīdiem terapijā ilgstoši lietoja arī perorālos steroīdus vidējā devā - prednizolonu 8 mg/dn. Pārsteidzošs izrādījās fakts, ka 15% pacientu nezināja par aspirīna in to leran ci, un tā tika apstiprināta tikai provokācijas testā.
Eiropas AIA pētījuma [8] rezultāti rāda, ka aspirīna intolerance astmas pacientu vidū tiek diagnosticēta nepietiekami.
Diagnostika un ārstēšana
Diagnostika
Ikviena gadījuma diagnostikā būtiska nozīme ir pacienta anamnēzei. Ja anamnēze ir neskaidra, diagnozes apstiprināšanai tiek veikts aspirīna provokācijas tests vietās, kur pieejama kardiopulmonālā reanimācija. Pacienta astmai jābūt remisijas periodā un FEV1 rādītājiem virs 70% no individuālā labākā mērījuma vai virs 1,5 litriem.
Aspirīna provokācijas testa veikšanai izstrādātas un nesen publicētas gan Eiropas, gan Amerikas vadlīnijas. Tās rekomendē orālās, inhalācijas vai nazālās provokācijas, kuru sensitivitāte, savstarpēji salīdzinot, daudz neatšķiras (89%, 77-90% un 80-87%). Kā zelta standarts abās vadlīnijās tiek minēts orālais provokācijas tests. Tā kā perorālā provokācija var izsaukt smagu reakciju, rekomendē arī inhalācijas provokāciju ar lizīnu-aspirīnu. Testu uzskata par pozitīvu, ja FEV1 vai PEF samazinās par 15% un to pavada bronhu obstrukcijas simptomi, acu un deguna kairinājums vai ja FEV1 un PEF samazinās par 20%. Orālajās provokācijās pierādīts, ka aspirīna sliekšņa deva, kas rada bronhokonstrikciju, var svārstīties individuāli no 10 mg līdz 600 mg. Mazāk jutīgas, bet drošākas ir nazālās provokācijas, ko rekomendē veikt ambulatori. [9]
Diemžēl pagaidām rutīnas lietošanai nav piemērota in vitro testa. Laboratorijās un klīniskajos pētījumos tiek pārbaudīti 3 jaunākie testi, ko pamato ar aspirīna/NSPL specifisko leikocītu aktivāciju perifērajās asinīs. Tie ir: sulfidoleikotriēnu atbrīvošanās raudze, bazofilo leikocītu aktivācijas tests un 15-HETE (hidroksi-eicosatetrenoidskābes) ģenerācijas tests.
Prof. Sampsons, rakstot par grūti ārstējamo astmu [12], kā vienu no sliktās diagnostikas cēloņiem min visu astmas pacientu piesardzību un atturēšanos lietot aspirīnu un NSPL, tādējādi maskējot iespējamo reakciju. Otrs cēlonis varētu būt vieglas un vēlīnas reakcijas, kas netiek saistītas ar medikamentu lietošanu. Nepietiekamā diagnostika nopietni apdraud astmas pacientus. Apstiprinot AIA diagnozi, rodas iespēja nozīmēt pacientam atbilstīgu alternatīvu medikamentu terapiju. Vēlams, lai pacientu rīcībā būtu rakstiski ieteikumi par aizliegtajiem NSPL un atļautajiem alternatīvajiem medikamentiem.
Ārstēšana
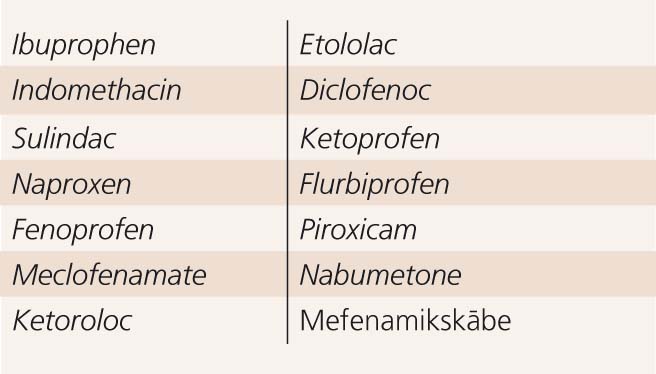
Ja aspirīna vai NSPL intolerance parādās, tā saglabājas visu turpmāko dzīvi. Pacientam ar AIA rekomendē izvairīties no aspirīna un to saturošo produktu lietošanas, kā arī hidrokortizona hemisukcināta. Diemžēl šāda izvairīšanās nepasargā no bronhiālās astmas progresēšanas. Pacientiem ar AIA nerekomendē lietot tādus NSPL, kas ir spēcīgi COG-1 inhibitori (indometacīns, naproksēns, diklofenaks, ibuprofēns), jo tie 30-80% gadījumu arī izraisa hipersensitīvas reakcijas. Ir savstarpējās krusteniskās reakcijas NSPL starpā (skat. 2. tabulu).

2. tabula
NSPL krusteniskās reakcijas 60–100% hipersensitīvo pacientu
Ikdienas praksē - īpaši pacientiem ar vēlīni sākušos astmu un deguna polipozi - iesaka izvairīties no aspirīna un citiem NSPL.
Pacientiem ar NSPL hipersensitivitāti speciāli aprīkotos stacionāros tiek piedāvāta desensibilizācija, ja NSPL nepieciešami citu slimību ārstēšanā. Latvijā šādas ārstēšanas iespējas pagaidām nav pieejamas. Pētījumi Polijā prof. Szczeclic vadībā [10] apstiprina, ka, veicot desensibilizāciju ar 600-1200 mg aspirīna dienā, mazinās iekaisums - īpaši deguna gļotādā. Ja NSPL tomēr jālieto, tiek rekomendēti ciklooksigenāzes (COG-2) inhibitori vai medikamenti ar vāju COG inhibēšanu (acetaminophen = paracetamols), sākumā ārsta uzraudzībā, pacientu novērojot vismaz stundu pēc medikamenta lietošanas. [11] AIA ārstēšanas pamatā ir inhalējamo glikokortikoīdu lietošana, kam papildus pievieno leikotriēnu receptoru antagonistus. [1]
EAACI/ENDA un GA2LEN/HANNA rekomendācijas aspirīna un citu NSPL hipersensitivitātes diagnostikā un ārstēšanā:
- diagnostika un ārstēšana atšķiras pēc iespējamā vai apstiprinātā reakcijas mehānisma;
- ādas un in vitro testus veic, ja ir aizdomas par IgE hipersensitīvo reakciju;
- ja iespējams, diagnozi apstiprina ar aizdomās turēto medikamentu;
- alternatīvā medikamenta drošība jāpārbauda ar orālu provokācijas testu;
- pēc diagnozes apstiprināšanas no vainīgā medikamenta jāizvairās;
- pacienta rīcībā jābūt rakstiskai informācijai par alternatīviem NSPL.