Patofizioloģija
Šim asinsvadu konglomerātam nav kapilāru tīkla, un barojošās artērijas drenējas tieši uz drenējošajām vēnām. Artērijām ir nepilnīgs muskuļu slānis, un drenējošās vēnas parasti ir palielinātas lielā asins plūsmas ātruma dēļ caur fistulu. Īsti nav skaidrs, kā notiek patoloģisko asinsvadu parādīšanās, bet tiek pētīta dezorganizētu vazoaktīvu proteīnu veidošanās saistība ar angioģenēzi. Neiroloģisku disfunkciju AVM rada trīs mehānismu ceļā.
- Var attīstīties subarahnoidāla, intraventrikulāra vai (visbiežāk) parenhimatoza hemorāģija.
- Ja nav hemorāģijas, tad kā sekas pēc AVM var attīstīties krampji (15–40%).
- Visretāk: progresējošs neiroloģisks deficīts var parādīties dažos mēnešos vai gados (6–12%), kas rodas "apzagšanas fenomena" dēļ. Neiroloģisko deficītu mēģina skaidrot arī ar masas efektu (AVM palielināšanās) vai drenējošo vēnu hipertensiju. [2]
Epidemioloģija
Sastopamība ASV ir aptuveni 0,1% no visas populācijas, tātad aptuveni 300 000 cilvēku Amerikā ir AVM, bet tikai 12% gadījumu tās ir simptomātiskas. Pacientiem ar hemorāģiju nāves risks ir 10–15%.
38–70% gadījumu AVM izpaužas ar hemorāģiju. Intrakraniālas hemorāģijas risks gadā ir 2–4%. Pacientiem ar hemorāģiju atkārtotas hemorāģijas risks pirmajos 12 mēnešos ir palielināts (7–33%). Hemorāģijas klīniskie un angiogrāfiskie riska faktori: vīriešu dzimums, mazs AVM izmērs, lokalizācija bazālajos ganglijos, mugurējā bedrē, dziļa venozā drenāža, viena vai tikai dažas drenējošās vēnas, angiogrāfijas laikā noteikts augsts spiediens barojošajās artērijās, intranidālas un plūsmas atkarīgās barojošās artērijas aneirismas.
AVM hemorāģijas klīniski (neiroloģiskais deficīts) ir smagākas kā ne–AVM hemorāģijas, taču atlabšana parasti ir labāka un ātrāka, ko var izskaidrot ar pacienta vecumu, jo jauniem pacientiem ātrāk noris smadzeņu funkcionālā reorganizācija. [2]
Klīniskā aina
Parasti diagnozi nosaka pirmreizēju krampju vai hemorāģijas laikā. Anamnēzē pacientam sūdzības par nelieliem mācīšanās traucējumiem, kas pieaugušā vecumā nebūs tik pamanāmi. 50% pacientu atzīmē galvassāpes, kas izpaužas kā klasiska migrēna vai ģeneralizētas galvassāpes. Jāievāc rūpīga krampju anamnēze: vienkārši, parciāli vai sekundāri ģeneralizēti. [1; 2; 3; 4; 5; 6]
Krampji un epilepsija
Pacientiem ar AVM bez hemorāģijas krampji kā pirmais simptoms var būt 15–40% gadījumu, tie var būt fokāli vai sekundāri ģeneralizēti. Terapijā lieto antikonvulsantus. Krampju riska faktori: jauni pacienti, liela izmēra AVM, lobāra lokalizācija (īpaši temporāla), a.cerebri media kā barojošās artērijas. Plīsušas AVM gadījumā krampji būs biežāk, ja hemorāģija ir kortikāla vai subarahnoidāla. [2; 6]
Galvassāpes un migrēna
Galvassāpes AVM gadījumā novēro reti, nesaistītas ar hemorāģiju novēro 4–14% gadījumu. [1; 2; 3; 4; 5; 6]
Vecums
Lai gan AVM ir iedzimts bojājums, tā visbiežāk parādās jauniem pieaugušajiem. Bieži anamnēzē pacientiem ir grūtības mācībās. [1; 2; 3; 4; 5; 6]
Fizikālā izmeklēšana
Pacientiem ar AVM un bez krampjiem vai hemorāģijas reti novēro fokālu neiroloģisku deficītu. Neiroloģisku deficītu biežāk novēro pacientiem, kam AVM ir smadzeņu stumbrā vai dziļi lokalizēta, biežāk sievietēm. Intraventrikulāras hemorāģijas gadījumā neiroloģiskais deficīts ir mazāk izteikts nekā citas hemorāģijas lokalizācijas gadījumā. Fokālais neiroloģiskais deficīts ir atkarīgs no AVM lokalizācijas. [1; 2]
Etioloģija
Nav identificēti ģenētiski, demogrāfiski vai vides riska faktori. No dažām ģimenēm, par kurām fiksēti ziņojumi, pārmantojamība ir autosomāli dominanta. Dažkārt cerebrālā AVM saistīta ar citām pārmantotām slimībām: Osler–Weber–Rendu sindromu, Sturge–Weber slimību, neirofibromatozi un von–Hipper–Lindau sindromu. [1; 2]
Diferenciāldiagnostika
- Kardioembolisks insults,
- sinus cavernosus sindromi,
- cerebrāla amiloīda angiopātija,
- cerebrālas aneirismas,
- cerebrāla venoza tromboze,
- kūlīšu tipa galvassāpes,
- disekcijas sindroms,
- subarahnoidāla hemorāģija,
- fibromuskulāra displāzija,
- intrakraniāla hemorāģija,
- migrēnas galvassāpes,
- Moyamoya slimība,
- A.cerebri posterior insults,
- Galēna vēnu malformācija. [2]
Diagnostika
Datortomogrāfijā (DT) parasti identificē intracerebrālu hemorāģiju. Par AVM jāaizdomājas gadījumos, ja pacients ir gados jauns, nav citu hemorāģijas riska faktoru. DT izmeklējumā var diagnosticēt lielas AVM. Magnētiskās rezonanses attēlveidošana (MRI) ir būtisks izmeklējums AVM diagnostikā. AVM izskatās kā neregulāras, globoīdas masas jebkurā smadzeņu puslodē vai smadzeņu stumbrā (1. attēls).
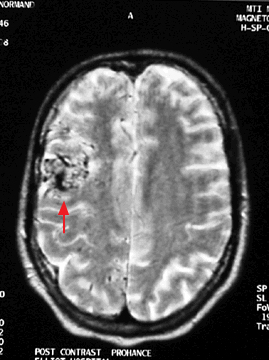

AVM labajā puslodē MRI izmeklējumā
AVM var būt kortikāla, subkortikāla vai dziļi baltajā vielā. Pacientiem ar aizdomām par AVM jāveic DT angiogrāfija. Ap AVM var būt redzams vāja signāla vai ekstracelulārs hemosiderīns, kas liecina par simptomātisku vai asimptomātisku iepriekšēju asiņošanu. Angiogrāfija (zelta standarts) ir nepieciešama hemodinamikas izvērtēšanai, kas būtiska terapijas plānošanai. AVM morfoloģija nosaka ārstēšanas algoritmu. Svarīgi izvērtēt barojošo artēriju, venozo drenāžu, arteriālas un venozas aneirismas. Piemērs 2. attēlā.
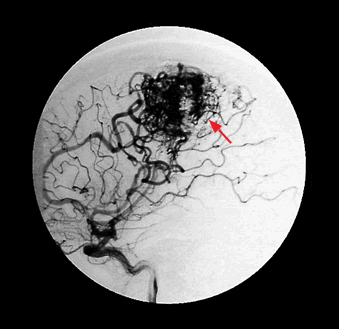

AVM angiogrāfijas izmeklējumā pirms terapijas
10–58% gadījumu pacientiem ar AVM ir arī aneirismas, kuras lokalizētas artērijās, kas baro AVM, vai pašā AVM konglomerātā. Intranidālām aneirismām ir lielāks ruptūras risks. Citas svarīgas angiogrāfijas pazīmes ir drenējošo vēnu samezglošanās vai ektāzijas, kas var izveidot venozu sastrēgumu, trombozi vai ruptūru un barojošās artērijas stenozi angiopātijas dēļ, ko izraisījusi spēcīgā un turbulentā plūsma fistulā.
Superselektīva angiogrāfija: veic kopā ar standarta angiogrāfiju caur a.femoralis. Speciālu lokanu, vadāmu katetru ievada miega artērijā vai vertebrālajā artērijā, tad sīkākos artēriju zaros, līdz nonāk tuvu AVM perēklim, var mērīt spiedienu barojošajā artērijā (ar koaksiālu katetru). Augsts spiediens barojošajā artērijā saistīts ar lielāku hemorāģijas risku. Tad var ievadīt anestēzijas līdzekli, lai radītu īslaicīgu anestēziju laukumā, ko artērija apgādā ar asinīm. Tad veic Wada testu, kas piecās minūtēs (kad darbojas anestēzija) ļauj izvērtēt valodu, atmiņu, redzi, jušanu, motorisko funkciju, nosakot, vai kāda no šīm funkcijām sākas tajā reģionā. Testa mērķis ir izvairīties no neiroloģiskā deficīta riska, jo operācijas laikā reģionu iespējams bojāt. Tad arī var izvērtēt artērijas, kas tieši baro AVM un pēc tam normālos audus. [1; 2; 6; 7]
Ārstēšana
Ārstēšanas taktika atkarīga no hemorāģijas riska, ko nosaka, izvērtējot pacientu individuāli, ņemot vērā demogrāfiskos, anamnēzes un angiogrāfijas datus. Ar lielāku hemorāģijas risku saistās hemorāģija anamnēzē, maza izmēra AVM, dziļa venozā drenāža, relatīvi augsts spiediens barojošajās artērijās.
Pagaidām nav pētījumu, kas salīdzinātu invazīvas ārstēšanas (embolizācijas un neiroķirurģiskas rezekcijas) un medikamentozas terapijas efektivitāti pacientam ar zināmu AVM. Ir neskaidrības par to, vai pacients ar AVM hemorāģiju jāārstē, lai novērstu nākamo hemorāģiju, ņemot vērā lielo atkārtotas hemorāģijas risku. Līdz šim vairākums pacientu ar nerupturējušu AVM arī bija invazīvas ārstēšanas kandidāti, lai izvairītos no hemorāģijas, bet par šo jautājumu notiek diskusijas, jo pacientiem ar zināmu AVM ir mazs hemorāģijas risks.
Jauniem pacientiem ar zināmu AVM invazīva iejaukšanās nepieciešama, ja ir kāds no AVM ruptūras riska faktoriem, bet vecākiem pacientiem vai pacientiem bez riska faktoriem ordinējami antikonvulsanti (fenitoīns, karbamazepīns, lamotrigīns) krampju kontrolei un analgētiķi adekvātai galvassāpju atsāpināšanai. [1; 2; 6; 7; 8]
Ķirurģiska ārstēšana
Trīs invazīvas metodes: endovaskulāra embolizācija, ķirurģiska rezekcija, fokāla radiācijas terapija. Metodes var kombinēt. Ķirurģiskās ārstēšanas riska noteikšanas skala 3. attēlā.
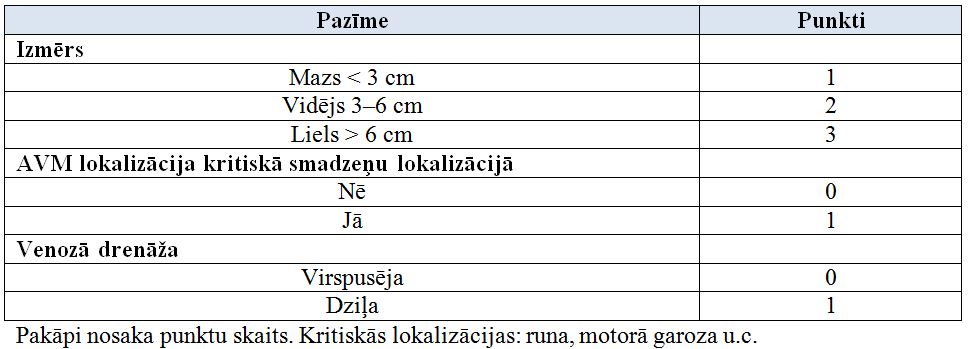

Ķirurģiskās ārstēšanas riska noteikšana pēc Spetzler–Martin skalas (I–V)
AHA AVM vadlīnijas
- Pacientiem ar Spetzler–Martin I un II pakāpi, viegli pieejamu malformāciju pirmā izvēles metode ir ķirurģiska ekstirpācija.
- Radioķirurģisku ārstēšanu iesaka Spetzler–Martin I un II, ja AVM ir mazāka par 3 cm un ir ķirurģiski grūti ekscidējama, palielināts risks pēc ķirurģiskas iejaukšanās.
- Spetzler–Martin III pakāpes AVM parasti rekomendē ārstēt ar multimodālu pieeju: embolizāciju un tad ķirurģisku ekstirpāciju, ja liels ķirurģijas risks (lokalizācija, vaskulāra anatomija), pēc embolizācijas var izmantot radioķirurģisku terapiju.
- Spetzler–Martin IV un V pakāpes AVM parasti multimodāla pieeja: embolizācija, radioķirurģija un/vai ķirurģija.
- Embolizāciju izmanto gadījumos, kad ir mērķis AVM izņemt pilnībā kopā ar citām ārstēšanas metodēm. Vienīgais izņēmums ir paliatīva embolizācija pacientiem ar Spetzler–Martin IV vai V ar venozās atplūdes obstrukciju vai īstu apzagšanas fenomenu. [1; 2]
Ķirurģiska rezekcija
Ķirurģiska rezekcija ir pilnīgas izārstēšanas pamata metode, visefektīvākā metode neliela izmēra, viegli ekscidējamu AVM gadījumā. Veic kraniotomiju, no sākuma izolē un liģē barojošās artērijas, tad rezecē samezglojumu, pašas pēdējās liģē drenējošās vēnas, lai nepaaugstinātos spiediens, kamēr rezecē samezglojumu. Arī arteriālās aneirismas var klipēt ķirurģiski, intranidālās, distālās aneirismas parasti ir plūsmas atkarīgas un izzūd, līdzko rezecē AVM. [1; 2]
Endovaskulāra embolizācija
Superselektīva endovaskulāra ārstēšana nozīmē trombozējoša līdzekļa (ātri reaģējošas akrilāta līmes, trombus inducējošu spirāļu vai mazu balonu) ievadīšanu AVM samezglojumā. Embolizācijas mērķis ir ātri bloķēt šuntu no barojošajām artērijām, kur ir augsts spiediens uz venozo sistēmu. Sērijveida embolizācija var samazināt AVM līdz sākotnējam izmēram, tad arī ir daudz drošāka ķirurģiska vai radioķirurģiska iejaukšanās. Tomēr embolizācijas gadījumā perēklī pieaug spiediens un ir īslaicīgs ruptūras risks. Operāciju parasti veic 1–2 dienas pēc embolizācijas. Embolizācija viena pati nav pietiekami efektīva, lai obliterētu AVM, lai gan literatūrā tādi gadījumi aprakstīti. [1; 2]
Radioķirurģija
Iespējama, ja AVM diametrs < 3 cm. Protonu stari, lineārais paātrinātājs vai gamma nazis ir biežāk izmantojamās metodes. Radioterapija darbojas, ierosinot trombozi. Pluss ir tas, ka tā ir neinvazīva metode. Ķirurģiskas ārstēšanas algoritms ir individuāls un pēc angiogrāfiskajām pazīmēm. Vispopulārākais algoritms ir viena vai vairākas embolizācijas atsevišķu hospitalizāciju laikā, kam seko ķirurģiska vai radioķirurģiska iejaukšanās. Ja ir hemorāģija, nepieciešama ilgāka hospitalizācija. [1; 2]
Komplikācijas
Visbīstamākā AVM dabiskās gaitas komplikācija ir intracerebrāla hematoma, tad jāizvērtē ārstēšanas ieguvumi un riski. Ķirurģiskās komplikācijas: paliekošs neiroloģisks deficīts. Ķirurģiskā iznākuma risks korelē ar Spetzler–Martin skalas punktu skaitu; lielāks punktu skaits (liela AVM, dziļa venozā drenāža un AVM lokalizācija kritiskās smadzeņu vietās) palielina operācijas risku. Ja pēc Spetzler–Martin skalas ir < 3 punkti, tad mirstība 0–2%, ja 4 vai 5, tad mirstības risks 0–9%. Embolizācijas komplikācijas: paliekošs neiroloģisks deficīts saistībā ar netīšu artēriju embolizāciju, kas ar asinīm apgādā veselos audus. [1; 2; 10]
Prognoze
Virspusējām, neliela izmēra AVM ir laba ilgtermiņa prognoze (iejaukšanās, iespējams, nav nepieciešama). Prognoze pēc AVM hemorāģijas parasti ir labāka nekā pēc cita etioloģiskā cēloņa izraisītas hemorāģijas, jo pacients ir jaunāks un smadzeņu funkcijas reorganizācija ātrāka. [1; 2; 10]
Citi apsvērumi
Vecums
Svarīgs nosacījums, kas jāņem vērā, pieņemot lēmumu par AVM ārstēšanu. Pacientiem ar paredzamu garāku dzīvildzi ir lielāks hematomas risks nākotnē, jo ar katru gadu tas pieaug par 2–4%. Terapiju biežāk iesaka bērniem un jauniem pieaugušajiem, vecākiem cilvēkiem ar īsāku gaidāmo dzīvildzi ārstēšana biežāk ir konservatīva. Hemorāģijas risks dzīves laikā: 105 – pacienta vecums gados, vecākam pacientam tas būs mazāks. [1; 2; 11; 12]
AVM lokalizācija
Bojājumi smadzeņu kritiskajos reģionos ir izaicinājums riska izvērtēšanai, zīmīgas izpausmes būs gan ķirurģisku komplikāciju, gan AVM ruptūras gadījumā. Tad labāk izvēlēties radioķirurģiju. [1; 2; 11; 12]
AVM izmērs
Lielākas AVM ir grūtāk ārstēt, taču nav pierādīts lielāks asiņošanas risks kā mazām AVM. AVM > 6 cm parasti ārstē konservatīvi. Dažos gadījumos pacientiem ar lielām AVM var izmantot endovaskulāru pieeju, lai samazinātu AVM apjomu. [1; 2; 11; 12]