Aknas ir ļoti jutīgas pret alkohola toksisko iedarbību. Ilgstošas alkohola lietošanas dēļ aknās rodas smagas pārmaiņas: aknu taukainā hepatoze, iekaisums un ciroze. Tomēr ne tikai alkohola lietošanas dēļ attīstās taukainā hepatoze — šajā rakstā pievērsīsimies ne–alkohola taukainās hepatozes diagnostikas un ārstēšanas īpatnībām.
Aknu taukaino hepatozi iedala ne–alkohola taukainā aknu slimībā (NATAS) un alkohola taukainā aknu slimībā (ATAS). NATAS ir makrovezikulāras tauku pārmaiņas aknās, kas nav saistītas ar pārmērīgu alkohola patēriņu. [1] NATAS ir ne tikai specifiska aknu slimība, bet arī agrīns sistēmisku slimību rādītājs. Tāpēc NATAS parasti saistīta ar kardiovaskulārām slimībām, hronisku nieru slimību, 2. tipa cukura diabētu (CD), aptaukošanos un dislipidēmiju. NATAS mūsdienās sastopama aizvien biežāk (īpaši augsti attīstītajās valstīs) un saistīta ar palielinātu kardiovaskulāro saslimstību un mirstību (1. tabula). [2]
![Stāvokļi, kas saistīti ar NATAS [3]](https://cdn.doctus.lv/media/2016/09/2/original/9551af672480.jpg)
![Stāvokļi, kas saistīti ar NATAS [3]](https://cdn.doctus.lv/media/2016/09/2/original/9551af672480.jpg)
1. tabula
Stāvokļi, kas saistīti ar NATAS [3]
NATAS iedala:
- ne–alkohola hepatoze (nonalcoholic fatty liver), kas ir aknu steatoze bez norādēm par hepatocelulāru bojājumu vai fibrozi un ar minimālu risku attīstīties cirozē un aknu mazspējā;
- ne–alkohola steatohepatīts (nonalcoholic steatohepatitis — NASH) — aknu steatoze ar iekaisumu un hepatocītu bojājumu (balonveida deģenerāciju) ar vai bez fibrozes, ar risku attīstīties cirozei, aknu mazspējai un (reti) aknu vēzim;
- NASH ciroze — ciroze ar pašreizējām vai iepriekšējam histoloģiskām norādēm par steatozi vai steatohepatītu. [4]
Tāpat var vienkārši izdalīt divās galvenās klīniski histoloģiskās grupās: ne–alkohola hepatoze un ne–alkohola steatohepatīts. [5]
Alkohola aknu slimībai raksturīgs iekaisums aknās, kas veidojas pēc aknu steatozes stadijas un var progresēt hroniskā hepatītā ar fibrozi vai cirozi. Alkohola hepatīts var izpausties no viegla līdz smagam, bieži akūtā formā, ja iepriekš ir hroniska aknu slimība. [6; 7; 8]
Alkohola aknu slimību iedala trīs stadijās: pirmā ir aknu steatoze, otrā — alkohola hepatīts, trešā — hronisks hepatīts ar fibrozi vai cirozi. Alkohola hepatīts ir pārmērīgas alkohola lietošanas rezultāts, radot aknu iekaisumu un funkciju traucējumu. Visas trīs histoloģiskās stadijas var izpausties vienlaicīgi. Vairāk nekā 50 % pacientu ir ciroze.
Pagaidām nav skaidrs, tieši cik lielam jābūt izlietotā alkohola daudzumam, lai sāktu attīstīties alkohola aknu slimība. Tomēr literatūrā biežāk minēts alkohola daudzums apmēram 100 g/dienā vairākus gadu desmitus vai mūža garumā vairāk nekā 30 g/dienā. Citur literatūrā aprak-sta, ka vīriešiem liels alkohola patēriņš ir vairāk par 80 g un sievietēm vairāk par 60 g etanola dienā. [9] Vieglu līdz vidēji smagu alkohola hepatītu definē pēc Maddrey diskriminantes funkcijas, kam jābūt mazāk par 32 punktiem, MELD score jābūt zem 18 vai Glāzgovas alkohola hepatīta aprēķinam (Glasgow alcoholic hepatitis score) jābūt mazākam par 8, nav aknu encefalopātijas pazīmju, bilirubīna uzlabošanās serumā vai Maddrey score samazināšanās pirmajā hospitalizācijas nedēļā.Smags alkohola hepatīts ir tad, ja Maddrey score ≥ 32 ar vai bez aknu encefalopātijas. [7]
Epidemioloģija
Rietumu pasaulē NATAS izplatība ir 20—50 %; to uzskata par 21. gadsimta nozīmīgāko aknu slimību. Aknu steatoze un NATAS konstatē visās vecumgrupās, to attīstības biežums palielinās, pieaugot ķermeņa masai (parasti 10—40 % virs normālās). [2] Taukainā hepatoze 10—15 % gadījumu attīstās cilvēkiem ar normālu svaru un 70 % ar aptaukošanos. Svarīgs ir tauku sadalījums: palielināts viscerālo tauku daudzums palielina aknu steatozes risku gan slaidiem, gan cilvēkiem ar aptaukošanos. Palielināts svars palielina risku attīstīties NASH. [10] NATAS biežāk ir vīriešiem. NATAS un NASH izplatība palielinās ar vecumu. [11; 12] Slaidiem cilvēkiem ar NATAS ir nozīmīgi palielināts viscerālais adipozitātes indekss, salīdzinot ar korpulento pacientu grupu. Slaidiem NATAS pacientiem biežāk var attīstīties CD, arteriālā hipertensija nekā NATAS pacientiem ar aptaukošanos. Pacientiem ar NATAS biežāk novēro centrāla tipa aptaukošanos, īpaši slaido pacientu grupā. [13]
Aprēķināts, ka rietumvalstīs NATAS ir apmēram 30 % pieaugušo un vismaz 10 % bērnu. 20—25 % pacientu ar NATAS ir NASH. NASH sastopamībai pasaulē ir tendence palielināties. [14] Pacientiem ar NASH ir palielināta mirstība kardiovaskulāru slimību, audzēju un ar aknu slimībām saistītu notikumu (arī hepatocelulāras karcinomas (HCC)) dēļ, salīdzinot ar vispārējo populāciju. [5] Pacientiem ar aptaukošanos vai 2. tipa CD apmēram 75 % gadījumu attīstās NATAS, 20 % — NASH. [5; 11]
NATAS ir biežākais aknu enzīmu palielināšanās iemesls ASV un kriptogēnās cirozes iemesls. [4] NATAS ir biežākais hronisku aknu slimību iemesls Ziemeļamerikā. [5] Visvairāk NATAS ir Austrumāzijas indiāņiem, latīņu etniskajā grupā. [15] Pašlaik Latvijā vēl nav veikti plaši pētījumi par aknu steatozi, tāpēc Latvijas aknu pacientu populāciju nevaram salīdzināt ar Eiropas vai pasaules datiem.
24—45 % gadījumu NATAS atklāj ar protonu magnētiskās rezonanses spektrometriju, 22 % gadījumu — ultrasonogrāfijas laikā, 3—23 % paaugstināta aknu enzīmu līmeņa dēļ, izslēdzot citas aknu slimības, 16—24 % — autopsijas laikā, 20 % — pēc transplantācijas datiem. [11]
Runājot par ATAS, Eiropā ir lielākais alkohola patēriņš uz vienu iedzīvotāju (11 l tīra alkohola gadā no 15 gadu vecuma). 15 % eiropiešu alkohola lietošana uzskatāma par pārmērīgu (> 40 g/d vīrieši un > 20 g/d sievietes), ar lielāko īpatsvaru vīriešu un jaunu cilvēku populācijā. [16]
ATAS ir arī viena no biežākajām aknu slimībām pasaulē un lielākais saslimstības un mirstības izraisītājs. ATAS ir biežākais progresējošu aknu slimību iemesls Eiropā, trešais biežākais novēršamais nāves cēlonis ASV. Alkohola hepatīts var izpausties gan akūtā, gan hroniskā formā, kas saistīta ar strauju aknu sintētiskās funkcijas samazināšanos, rezultējas ar palielinātu mirstību. 30—50 % pacientu ar smagu alkohola hepatītu mirst. [17]
Etioloģija un patoģenēze
NATAS ir klīniski histoloģisks sindroms, ko histopatoloģiski raksturo makrovezikulāra steatoze ar dažādu veidu iekaisumu, balonveida deģenerāciju un fibrozi. Tā attīstās arī tad, ja alkoholu nelieto vispār vai lieto nelielā daudzumā (< 2—3 vienībām/dienā). [5]
Kā steatoze attīstītās par steatohepatītu?
Aknu steatoze attīstās tad, kad taukskābju piegāde aknām pārsniedz pieprasījumu pēc triglicerīdu, fosfolipīdu un holesterīna sintēzes un mitohondriālās oksidācijas. [1] Aknu šūnu bojājums veidojas, kad tauku daudzums hepatocītos pārsniedz normālās rezerves ar pastiprinātu tauku uzņemšanu, lokālo sintēzi vai nespēju patērēt taukskābes. Lipotoksicitāte attīstās no taukskābju akumulēšanās un var izraisīt šūnu nāvi. Oksidēto lipīdu un peroksidāzes produktu atbrīvošanās var ietekmēt NASH raksturīgo iekaisuma reakciju. [11]
Adipocīti
Tauku šūnas ir ļoti svarīgas enerģijas homeostāzē, kalpo par “enerģijas banku”, no kuras enerģija tiek atbrīvota pēc vajadzības. Ja uzņem vairāk kaloriju, nekā organismam nepieciešams, liekā enerģija tiek iepakota triglicerīdos. Tā ir visvērtīgākā “valūta”, jo brīvo taukskābju oksidācija dod vairāk enerģijas nekā proteīnu un ogļhidrātu oksidācija. Toties bez “enerģijas bankas” tauku šūnas ir metaboliski aktīvs orgāns ar endokrīnām un iekaisuma funkcijām, proti citokīni, adipocitokīni. Jo īpaši tas attiecināms uz viscerāliem taukiem (attēlā).
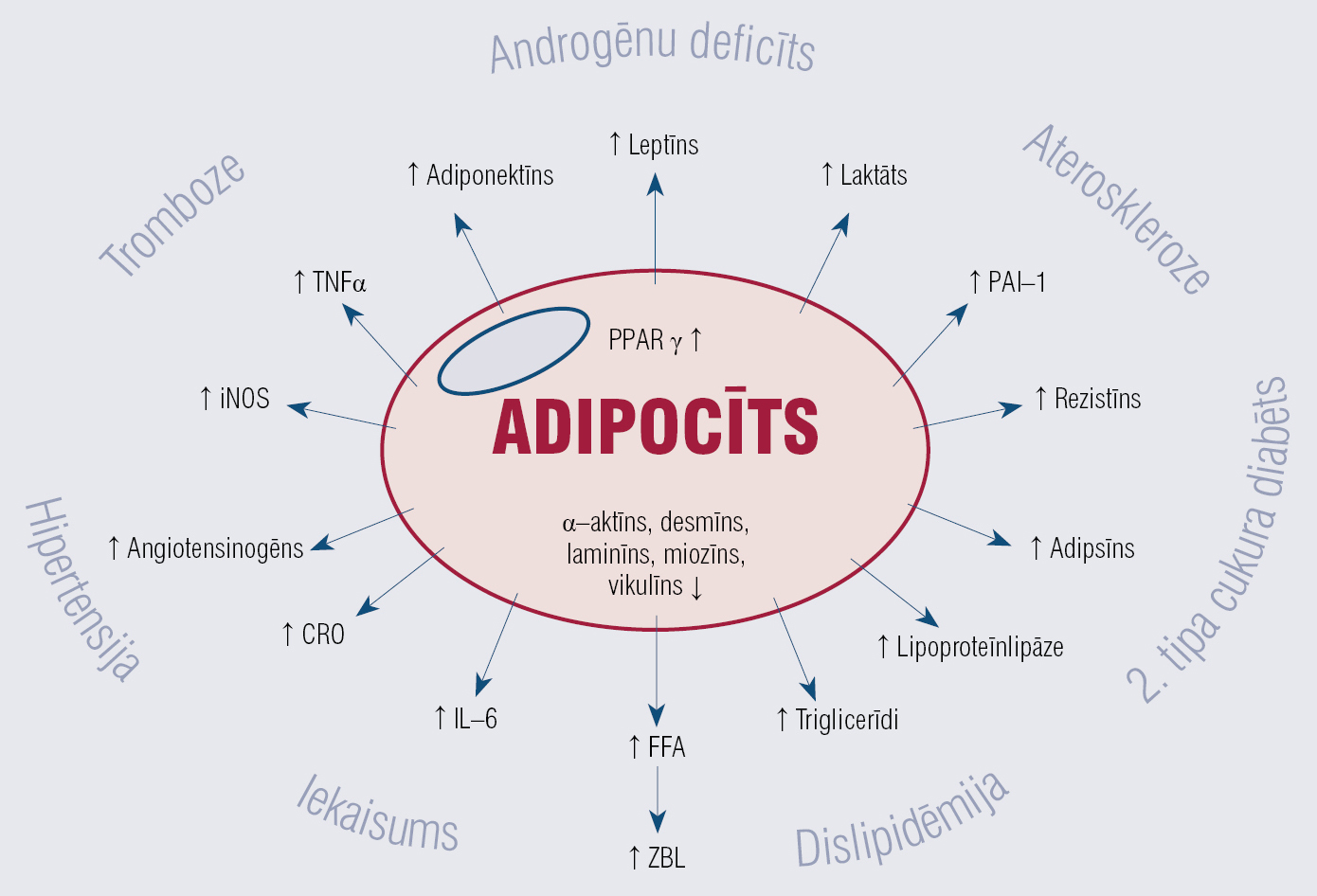

Attēls
Adipocīta funkcijas
Triglicerīdu uzkrāšanās
Tauki aknās uzkrājas disbalansa dēļ starp triglicerīdu (TG) sintēzi, utilizāciju un sekrēciju, tādējādi viss liekais tiek noglabāts krātuvē (aknās) taukskābju veidā. Vairāki dažādu līmeņu pētījumi atbalsta modeli, ka TG pārmērīga uzkrāšanās hepatocelulāri izskaidrojama ar palielinātu perifēro lipolīzi tauku šūnu insulīna rezistences dēļ, palielinātu aknu lipoģenēzi hiper-insulinēmijas dēļ, pārmērīgi ēdot. [18]
Faktori, kas potenciāli varētu ietekmēt fibrozes pāreju cirozē, ir mitohondriju bojājums, zvaigžņveida šūnu aktivācija, mikrovaskulārs bojājums, oksidatīvais stress un profibrogēno citokīnu aktivācija (piemēram, saistaudu augšanas faktors, transformējošais augšanas faktors bēta). [11] ATAS patoģenēze saistīta gan ar oksidatīvo stresu, disbiozi, iedzimtās un iegūtās imūnsistēmas disregulāciju, gan arī ar aknu parenhīmas šūnu bojājumu un aknu zvaigžņveida šūnu aktivāciju. [17]
Riska faktori
Iespējamie NATAS riska faktori ir aptaukošanās, insulīna rezistence (metaboliskais sindroms, 2. tipa CD), [10; 12], hipetrigliceridēmija, zems ABLH līmenis [5], kā arī ģenētiskie faktori, piemēram, patatīnam līdzīgās fosfolipāzes domēnu saturošā proteīna 3 (PNPLA3) variants I148M, kas saistīts ar palielinātu NATAS risku un aug-stāku smaguma pakāpi. [19] Steatohepatīta attīstību var veicināt arī nopietns svara zudums (jejuno–ileāla anastamoze, smags bada stāvoklis), medikamenti (piemēram, amiodarons, diltiazems, tamoksifēns, steroīdi, antiretrovirālā terapija), refeeding sindroms, saskare ar toksiskām vielām (piemēram, organiskiem šķīdinātājiem, dimetilformamīdu). [12]
Diagnostika
Visbiežāk aknu steatozi atklāj asimptomātiskiem pacientiem rutīnas sijājošā diagnostikā USG izmeklējumā. Galvenie sijājošās diagnostikas iemesli parasti ir paaugstināts aknu enzīmu AlAT, AsAT, SF līmenis vai izmaiņas USG/DT izmeklējumos. Simptomi visbiežāk nespecifiski: nogurums, sāpīgums vai pilnuma sajūta labajā augšējā kvadrantā, muskuļu vājums un dzelte (reti). Nogurums ir biežākais simptoms, taču nekorelē ar histoloģiski pierādāmu aknu bojājuma smagumu, klīniskajā praksē grūti izvērtējams simptoms. Dzelte liecina par jau progresējušu aknu slimību. [4; 11; 12] Lielākā daļa simptomu nav saistīti ar slimības smagumu. [11] Tomēr nieze, anoreksija un slikta dūša var norādīt uz nopietnu aknu slimību. [12]
Svarīgi pacientam jautāt par svara izmaiņām pēdējā laikā (svara zudumu, vēdera apkārtmēra palielināšanos), cukura diabētam raksturīgiem simptomiem (poliūriju, polidipsiju), ģimenes anamnēzē zināmu aknu steatozes gadījumu, ēšanas (trekni un ātrās ēdināšanas produkti) un alkohola lietošanas paradumiem. [4; 11]
Kritēriji
Lai diagnosticētu NATAS, jāatbilst šādiem kritērijiem: aknu steatoze, kas pierādīta ar attēldiagnostikas metodēm vai histoloģiju; alkohola lietošana ikdienā nav nozīmīga (etanola deva < 210 g/nedēļā vīriešiem, < 140 g/nedēļā sievietēm), izslēgtas citas aknu slimības, nav tādu pavadošu hronisku aknu blakusslimību kā hemohromatoze, Vilsona slimība, autoimūnas slimības un hronisks vīrushepatīts. [4; 10; 20]
Lai diagnosticētu alkohola hepatītu, rūpīgi jāievāc anamnēze, kas ne vienmēr ir viegli, jo bieži vien encefalopātijas vai akūta reibuma dēļ pacients par sevi neko nevar pastāstīt. Tāpēc, ja diagnoze nav līdz galam skaidra, anamnēzes dati jāievāc no piederīgajiem. [9]
Alkohola hepatītam raksturīgi drebuļi, drudzis, pēkšņa bilirubīna un/vai INR palielināšanās, kas komplicējas ar ascītu, encefalopātiju vai varikozu asiņošanu. AsAT > AlAT parasti vairāk nekā 2 : 1, bet AsAT parasti ir mazāk par 500 DV/l. Rekomendē aknu punkcijas biopsiju, vislabāk transjugulāru, jo ap 30 % gadījumu diagnoze tiek sajaukta. Literatūrā norādīts, ka biežāk veic transjugulāru biopsiju, tomēr, veicot perkutānu biopsiju (tru–cut),pacientiem ar smagāku alkohola hepatītu bieži atklāj aknu cirozi. [17] Biopsija jāveic tikai smagiem pacientiem, piemēram, ar smagu steatohepatītu. [21]
Attēldiagnostika
Lai gan daudzviet pasaulē par aknu taukaino pārmaiņu galveno pierādīšanas metodi izmanto USG un DT, tomēr mērenas aknu steatozes gadījumā izmeklējumu jutība ir niecīga (USG zem 20—30 %). Ar DT var objektīvi izmērīt viscerālo tauku daudzumu, tomēr radiācijas deva un izmaksas neattaisno šīs metodes izmantošanu. Lai arī aknu taukainās izmaiņas diagnosticē, aknu—liesas attiecībai (A/L attiecībai) DT esot virs 0,9, jutība nav augsta, tāpēc, pat ja šī attiecība ir 0,9 vai augstāka, ar šo metodi nevar izslēgt taukaino hepatozi. Attēldiagnostikas izmeklējumos redzamās aknu izmaiņas nekorelē ar fibrozes pakāpi, drīzāk korelācija samazinās līdz ar fibrozes progresiju NASH gadījumā. Tāpēc ar attēldiagnostikas metodēm nosakāmā steatozes pakāpe nevar kalpot par NATAS smaguma kritēriju. Magnētiskās rezonanses spektrometrija ir viena no precīzākajām aknu taukaino izmaiņu noteikšanas metodēm, bet pagaidām to lieto zinātniskiem nolūkiem un finansiāli tā nav izdevīga. [20]
Biopsija
Aknu punkcijas biopsija ir aknu steatozes un fibrozes diagnostikas “zelta standarts”, tomēr šai metodei ir trūkumi: sāpīgums, nepareiza biopsijas vietas izvēle, lielas izmaksas, atkarība no veicēja, komplikāciju risks (galvenokārt asiņošana). Biopsiju vajadzētu veikt tikai pacientiem, kam ir ultrasonogrāfiska aknu steatozes aina ar steatohepatīta riska faktoriem, kā arī tiem, kam aknu enzīmu līmenis ir paaugstināts bez noteiktas diagnozes. [2; 5]
Aprēķinu skalas aknu steatozes noteikšanai
Tā kā attēldiagnostikas metodēm ir ierobežojumi NATAS izvērtēšanā, izveidoti daži prognozes rādītāji, piemēram, taukaino aknu indekss (fatty liver index — FLI), NATAS aknu taukainības radītājs (NAFLD liver fat score), aknu steatozes indekss (hepatc steatosis index — HSI) un Steato tests (ST). FLI ir neatkarīgs aknu radītas mirstības riska rādītājs, ko aprēķina pēc ĶMI, vidukļa apkārtmēra, triglicerīdu un GGT līmeņa. HSI rēķina pēc ĶMI, AsAT/AlAT attiecības, dzimuma un CD esības/neesības. Abas sistēmas vērtējamas kā derīgas. [20]
Pacientiem ar izteiktu aknu steatozi AlAT, AsAT un GGT var būt arī references intervālā. [22]
Elastogrāfija
Ja izmeklējot nevar izslēgt nozīmīgu fibrozi, jāveic elastogrāfija. Ja atklāj nozīmīgu fibrozi, rekomendē aknu biopsiju. Elastogrāfijai ir vairāk viltus pozitīvu nekā negatīvu rezultātu. Ierobežojošie faktori šā izmeklējuma veikšanai ir augsts ĶMI un bieza krūškurvja kroka. Vairākos pētījumos Eiropā pierādīts, ka izteikti adipozu cilvēku elastogrāfijas rezultāti nav ticami pat 20 % gadījumu. Tomēr pašlaik trūkst nozīmīgu šķērsgriezuma pētījumu, kur biopsijas rezultāti būtu salīdzināti ar neinvazīvām metodēm. [23]
Pilnu raksta versiju lasiet 2016. gada oktobra numurā!